治疗步骤
PE 的严重程度基于早期死亡的预估风险。[85]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.http://www.onlinejacc.org/content/67/8/976http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com 考虑因素包括血流动力学稳定性(收缩压>90 mmHg 或收缩压<90 mmHg)和临床可能性(Wells 量表或 Geneva 评分)。
血流动力学不稳定的患者需要紧急再灌注、抗凝和支持性治疗。对于那些处于不良结局中度风险的患者,需要进行抗凝治疗和持续监测,并应考虑进行补救再灌注。对于不良结局风险较低的患者,应考虑早期出院或使用适当的抗凝药进行家庭治疗,并应谨慎考虑患者的个人情况。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[85]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.http://www.onlinejacc.org/content/67/8/976http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com
伴有休克或低血压的疑似 PE 患者
高危患者(表现为休克或低血压 [即,收缩压<90 mmHg])需要利用再灌注、抗凝疗法和支持疗法进行积极的治疗。
应立即给予支持治疗和经验抗凝(除非有禁忌),不得延迟。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com在该人群中可能优选普通肝素 (UFH);[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com不过,对于抗凝剂的选择可能受诸多患者因素的影响,例如出现癌症、妊娠、肾功能情况、肝功能情况、肥胖和出血风险(例如,血流动力学稳定性、系统性溶栓治疗、是否有延长抗凝治疗的需要)。选择还可依赖于医生或患者的偏好,以及当地指南的推荐。
支持疗法
应当遵循当地的复苏方案。
呼吸支持
应给予高浓度供氧,以氧饱和度 94%-98% 为目标(或者对于有高碳酸性呼吸衰竭风险的患者来说,以 88%-92% 为目标)。[141]O'Driscoll BR, Howard LS, Earis J, et al; British Thoracic Society Emergency Oxygen Guideline Group; BTS Emergency Oxygen Guideline Development Group. BTS guideline for oxygen use in adults in healthcare and emergency settings. Thorax. 2017 Jun;72(Suppl 1):ii1-90.https://www.brit-thoracic.org.uk/document-library/clinical-information/oxygen/2017-emergency-oxygen-guideline/bts-guideline-for-oxygen-use-in-adults-in-healthcare-and-emergency-settings/http://www.ncbi.nlm.nih.gov/pubmed/28507176?tool=bestpractice.com
对于有严重低氧血症/呼吸衰竭的患者来说,可能需要插管和机械通气。机械通气可能导致低血压,故需密切监测血压。
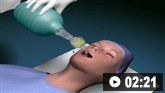 气管插管的动画演示
气管插管的动画演示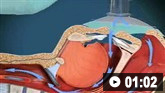 球囊面罩通气的动画演示
球囊面罩通气的动画演示
静脉输液
如果患者收缩压<90 mmHg,则应对其给予静脉输液。急性右心衰竭引起的全身血流输出降低是导致肺栓塞患者死亡的主要原因。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com
研究显示,过于积极地扩容没有益处,还可能因机械性过度扩张、或通过反流机制抑制收缩,而加重右心室功能不全。然而,适度的容量负荷试验(即,500 mL)可能有益于 PE 、心脏指数较低和血压正常的患者。[145]Mercat A, Diehl JL, Meyer G, et al. Hemodynamic effects of fluid loading in acute massive pulmonary embolism. Crit Care Med. 1999 Mar;27(3):540-4.http://www.ncbi.nlm.nih.gov/pubmed/10199533?tool=bestpractice.com
血管活性药
若收缩压<90 mmHg,可在接受(或在等待接受)药物、手术、或干预性再灌注治疗的同时给予升压药。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com
去甲肾上腺素可改善左心室功能和右心室冠状动脉灌注。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com 然而,对于低血压患者,此种方法可能较为有限。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com
多巴酚丁胺可增强收缩力并增加每搏量和心输出量。但是,其系统性血管舒张效应可导致低血压。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com
肾上腺素结合了去甲肾上腺素(血管收缩和右心室灌注增加,正性肌力作用)和多巴酚丁胺(正性肌力作用)的优势,但没有后者的血管扩张效应。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[146]Layish DT, Tapson VF. Pharmacologic hemodynamic support in massive pulmonary embolism. Chest. 1997 Jan;111(1):218-24.http://www.ncbi.nlm.nih.gov/pubmed/8996020?tool=bestpractice.com
急性期抗凝治疗
除非有禁忌,否则有疑似 PE 的患者均应在急性期(在诊断 PE 后的最初 10 天内)接受抗凝药物治疗。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com 如果随后排除肺栓塞诊断,则可停止抗凝治疗。对于确诊肺栓塞的患者,抗凝治疗应持续至少 3 个月。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[85]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.http://www.onlinejacc.org/content/67/8/976http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com
急性期胃肠外抗凝治疗(普通肝素 [UFH]、低分子肝素或磺达肝癸钠)应与维生素 K 拮抗剂 (VKA) 治疗的展开有所重叠。对于高危 PE 患者(对这些患者考虑再灌注治疗 [即,系统性溶栓疗法或取栓术]),急性期的治疗优选使用 UFH 进行至少 5 天的胃肠外抗凝治疗。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com当国际标准化比值 (INR) 达到 2.0 至3.0 时,即可停用肠外 UFH。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[85]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.http://www.onlinejacc.org/content/67/8/976http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.comUFH 的半衰期较短,易于监测,且容易被鱼精蛋白逆转。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com
两种直接口服抗凝药,利伐沙班和阿哌沙班,可无需预先经胃肠外抗凝药治疗即直接使用。但是,达比加群和依度沙班均需先使用胃肠外抗凝药治疗 5 至 10 天。一项 Meta 分析发现直接口服抗凝剂与肝素/VKA 方案的有效性相似,但大出血的风险更低(相对危险度 0.61,95% CI 0.21-0.68)。[85]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.http://www.onlinejacc.org/content/67/8/976http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com[147]van Es N, Coppens M, Schulman S, et al. Direct oral anticoagulants compared with vitamin K antagonists for acute venous thromboembolism: evidence from phase 3 trials. Blood. 2014 Sep 18;124(12):1968-75.http://www.bloodjournal.org/content/124/12/1968.longhttp://www.ncbi.nlm.nih.gov/pubmed/24963045?tool=bestpractice.com另外,直接口服抗凝剂无需监测,迅速起效且作用时间短。直接口服抗凝剂不与食物相互作用,但可与其他药物相互作用。达比加群可被依达赛珠单抗逆转。美国食品药品监督管理局已批准 andexanet alfa 用于逆转有致命性或无法控制出血患者的由阿哌沙班和利伐沙班介导的抗凝作用。目前还没有已批准用于逆转依度沙班的药物。
欧洲指南推荐肥胖患者和患有重度肾功能损伤的患者(肌酐清除率<30 mL/min)使用 UFH。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com美国胸科医师学会推荐患有重度肾功能损伤的患者使用 VKA。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com
对于癌症活跃或有肝损伤和凝血障碍的患者,首选 LMWH 作为初始抗凝治疗药物。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com [  ]How do low‐molecular‐weight heparin (LMWH), vitamin K agonists (VKAs), and direct oral anticoagulants (DOACs) compare for treatment of venous thromboembolism (VTE) in people with cancer?https://cochranelibrary.com/cca/doi/10.1002/cca.2255/full显示答案
]How do low‐molecular‐weight heparin (LMWH), vitamin K agonists (VKAs), and direct oral anticoagulants (DOACs) compare for treatment of venous thromboembolism (VTE) in people with cancer?https://cochranelibrary.com/cca/doi/10.1002/cca.2255/full显示答案
医务人员在给存在肾或肝损伤的患者开直接口服抗凝剂的处方前应参考药物说明和/或当地药典。
磺达肝癸钠存在较低的导致肝素诱导的血小板减少症 (HIT) 的风险,并且似乎对疑似或确诊 HIT 的患者有效。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[148]Kang M, Alahmadi M, Sawh S, et al. Fondaparinux for the treatment of suspected heparin-induced thrombocytopenia: a propensity score-matched study. Blood. 2015 Feb 5;125(6):924-9.http://www.bloodjournal.org/content/125/6/924.longhttp://www.ncbi.nlm.nih.gov/pubmed/25515959?tool=bestpractice.com禁忌用于存在重度肾功能损伤的患者。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com
妊娠
LMWH 推荐用于妊娠女性(根据体重调整剂量)或可能妊娠的女性。[36]Bates SM, Greer IA, Middeldorp S, et al. VTE, thrombophilia, antithrombotic therapy, and pregnancy. Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest. 2012 Feb;141(2 Suppl):e691S-736S.https://journal.chestnet.org/article/S0012-3692(12)60136-6/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/22315276?tool=bestpractice.com[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com LMWH 不穿过胎盘,且通常无需常规监测。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[149]Royal College of Obstetricians and Gynaecologists. Reducing the risk of venous thromboembolism during pregnancy and the puerperium. Green-top guideline No. 37a. Apr 2015 [internet publication].https://www.rcog.org.uk/globalassets/documents/guidelines/gtg-37a.pdf其他抗凝剂(包括 VKA),可能会穿过胎盘。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com
休克或低血压患者的再灌注治疗
推荐有血流动力学改变(休克或收缩压<90 mmHg)的患者进行系统性溶栓治疗,因该组患者的死亡率较高。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[85]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.http://www.onlinejacc.org/content/67/8/976http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com[150]Hao Q, Dong BR, Yue J, et al. Thrombolytic therapy for pulmonary embolism. Cochrane Database Syst Rev. 2015 Sep 30;(9):CD004437.http://cochranelibrary-wiley.com/doi/10.1002/14651858.CD004437.pub4/fullhttp://www.ncbi.nlm.nih.gov/pubmed/26419832?tool=bestpractice.com[151]Chatterjee S, Chakraborty A, Weinberg I, et al. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis. JAMA. 2014 Jun 18;311(23):2414-21.https://jamanetwork.com/journals/jama/fullarticle/1881311http://www.ncbi.nlm.nih.gov/pubmed/24938564?tool=bestpractice.com
在大面积肺栓塞患者(存在持续性低血压 [即,收缩压<90 mmHg 且至少持续 15 分钟] 的急性 PE 患者)中,与接受单独抗凝治疗的患者相比,接受系统性溶栓治疗患者的全因死亡率更低。[150]Hao Q, Dong BR, Yue J, et al. Thrombolytic therapy for pulmonary embolism. Cochrane Database Syst Rev. 2015 Sep 30;(9):CD004437.http://cochranelibrary-wiley.com/doi/10.1002/14651858.CD004437.pub4/fullhttp://www.ncbi.nlm.nih.gov/pubmed/26419832?tool=bestpractice.com[151]Chatterjee S, Chakraborty A, Weinberg I, et al. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis. JAMA. 2014 Jun 18;311(23):2414-21.https://jamanetwork.com/journals/jama/fullarticle/1881311http://www.ncbi.nlm.nih.gov/pubmed/24938564?tool=bestpractice.com[152]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.https://academic.oup.com/eurheartj/article/36/10/605/514452http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
理想情况下,在开始溶栓治疗前,应通过CT 肺动脉造影 (CTPA) 确诊 PE。[85]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.http://www.onlinejacc.org/content/67/8/976http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com不过,肺通气-灌注 (V/Q) 扫描结果阴性可有效排除 PE,并且为一种无辐射和无需造影剂的操作。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com但若患者有即将发生心搏骤停的风险,则可仅基于临床表现即开始治疗。[86]British Thoracic Society Standards of Care Committee Pulmonary Embolism Guideline Development Group. British Thoracic Society guidelines for the management of suspected acute pulmonary embolism. Thorax. 2003 Jun;58(6):470-83.http://thorax.bmj.com/content/58/6/470.longhttp://www.ncbi.nlm.nih.gov/pubmed/12775856?tool=bestpractice.com
系统性溶栓治疗可促进栓子立刻溶解并改善右心室功能、肺血流量和肺灌注。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[152]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.https://academic.oup.com/eurheartj/article/36/10/605/514452http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com一项关于急性 PE 患者的 Meta 分析中,与单独使用肝素相比,溶栓与肝素联合治疗可显著降低 30 天的死亡率(3.9% [40/1024] vs 2.3% [24/1033];集合比值比 [OR] 0.59,95% CI 0.36 至 0.96,P=0.03)。[152]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.https://academic.oup.com/eurheartj/article/36/10/605/514452http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com但是溶栓可显著增加大出血的风险。[150]Hao Q, Dong BR, Yue J, et al. Thrombolytic therapy for pulmonary embolism. Cochrane Database Syst Rev. 2015 Sep 30;(9):CD004437.http://cochranelibrary-wiley.com/doi/10.1002/14651858.CD004437.pub4/fullhttp://www.ncbi.nlm.nih.gov/pubmed/26419832?tool=bestpractice.com[151]Chatterjee S, Chakraborty A, Weinberg I, et al. Thrombolysis for pulmonary embolism and risk of all-cause mortality, major bleeding, and intracranial hemorrhage: a meta-analysis. JAMA. 2014 Jun 18;311(23):2414-21.https://jamanetwork.com/journals/jama/fullarticle/1881311http://www.ncbi.nlm.nih.gov/pubmed/24938564?tool=bestpractice.com[152]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.https://academic.oup.com/eurheartj/article/36/10/605/514452http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com接受溶栓治疗联合肝素治疗的患者发作大出血的人数要多于仅接受抗凝治疗的患者(9.9% [96/974] vs 3.6% [35/961];OR 2.91,95% CI 1.95 至 4.36)。[152]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.https://academic.oup.com/eurheartj/article/36/10/605/514452http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com颅内或致命性出血的发病率在溶栓组患者中报道为 1.7%,在抗凝药组为 0.3%。[152]Marti C, John G, Konstantinides S, et al. Systemic thrombolytic therapy for acute pulmonary embolism: a systematic review and meta-analysis. Eur Heart J. 2015 Mar 7;36(10):605-14.https://academic.oup.com/eurheartj/article/36/10/605/514452http://www.ncbi.nlm.nih.gov/pubmed/24917641?tool=bestpractice.com
溶栓的绝对禁忌证包括:出血性脑卒中或任何时间不明原因的卒中;近 6 个月有缺血性卒中;中枢神经系统损伤或肿瘤;近期重大创伤/手术/头部损伤(3 周前);近 1 个月内胃肠道出血;有已知出血风险。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[153]Van de Werf F, Ardissino D, Betriu A, et al; task force on the management of acute myocardial infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2003 Jan;24(1):28-66.https://academic.oup.com/eurheartj/article/24/1/28/562262http://www.ncbi.nlm.nih.gov/pubmed/12559937?tool=bestpractice.com
溶栓的相对禁忌证包括:近 6 个月内的短暂性脑缺血发作;口服抗凝剂治疗;妊娠,或处于产后 1 周内;创伤性复苏(与此次 PE 发作相关);难治性高血压(收缩压>180 mmHg);肝病晚期;感染性心内膜炎;活动性消化性溃疡。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[153]Van de Werf F, Ardissino D, Betriu A, et al; task force on the management of acute myocardial infarction of the European Society of Cardiology. Management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2003 Jan;24(1):28-66.https://academic.oup.com/eurheartj/article/24/1/28/562262http://www.ncbi.nlm.nih.gov/pubmed/12559937?tool=bestpractice.com
对于血流动力学稳定的急性 PE 患者,通常不给予溶栓治疗。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com对于血压正常的具中等 PE 风险(不伴明显血流动力学改变的急性右心室功能不全和心肌损伤)的患者来说,再灌注溶栓治疗联合肝素治疗与单独使用肝素相比,可预防血流动力学失代偿,但增加了大出血和卒中的风险。[154]Meyer G, Vicaut E, Danays T, et al; PEITHO Investigators. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med. 2014 Apr 10;370(15):1402-11.https://www.nejm.org/doi/10.1056/NEJMoa1302097http://www.ncbi.nlm.nih.gov/pubmed/24716681?tool=bestpractice.com
手术取栓或导管直接溶栓治疗
系统性溶栓治疗增加出血风险,包括颅内出血风险。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com手术取栓术和导管直接溶栓治疗所致出血的风险低于系统性溶栓,故可考虑对因存在出血风险而无法接受溶栓治疗的高危患者、或没有时间进行充分有效的系统性溶栓治疗、或该治疗失败的患者使用。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com[155]Dolovich LR, Ginsberg JS, Douketis JD, et al. A meta-analysis comparing low-molecular-weight heparins with unfractionated heparin in the treatment of venous thromboembolism: examining some unanswered questions regarding location of treatment, product type, and dosing frequency. Arch Intern Med. 2000 Jan 24;160(2):181-8.https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/485206http://www.ncbi.nlm.nih.gov/pubmed/10647756?tool=bestpractice.com[156]Konstantinides SV, Barco S. Systemic thrombolytic therapy for acute pulmonary embolism: who is a candidate? Semin Respir Crit Care Med. 2017 Feb;38(1):56-65.http://www.ncbi.nlm.nih.gov/pubmed/28208199?tool=bestpractice.com
对于系统性溶栓治疗失败或为绝对禁忌的患者,推荐进行手术取栓术。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com取栓术后的死亡率从 4% 至 27%。[157]Fukuda I, Daitoku K. Surgical embolectomy for acute pulmonary thromboembolism. Ann Vasc Dis. 2017 Jun 25;10(2):107-14.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5579785/http://www.ncbi.nlm.nih.gov/pubmed/29034035?tool=bestpractice.com一个小队列中因急性大面积肺栓塞而接受手术取栓的患者,其 10 年生存率为 84%。[158]Fukuda I, Taniguchi S, Fukui K, et al. Improved outcome of surgical pulmonary embolectomy by aggressive intervention for critically ill patients. Ann Thorac Surg. 2011 Mar;91(3):728-32.https://www.annalsthoracicsurgery.org/article/S0003-4975(10)02483-5/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/21352987?tool=bestpractice.com
导管直接溶栓治疗通常联合机械和药物血栓溶解治疗,可考虑对全剂量系统性溶栓治疗失败的患者使用。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com导管直接溶栓治疗使用的溶栓药物剂量较低(约为全剂量系统性溶栓治疗的三分之一)并且认为其能够降低远端的出血风险(例如,颅内或胃肠道内)。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com一项 Meta 分析纳入了关于导管直接溶栓治疗的非随机临床试验,该分析报道的临床成功率为 87%,且相关的严重和轻度并发症风险分别为 2% 和 8%。[159]Kuo WT, Gould MK, Louie JD, at al. Catheter-directed therapy for the treatment of massive pulmonary embolism: systematic review and meta-analysis of modern techniques. J Vasc Interv Radiol. 2009 Nov;20(11):1431-40.http://www.ncbi.nlm.nih.gov/pubmed/19875060?tool=bestpractice.com
静脉滤器
对于有抗凝治疗绝对禁忌证的急性 PE 患者、在急性期出现大出血事件的患者或尽管采取了充分抗凝但仍确诊复发 PE 的患者,可放置下腔静脉 (IVC) 滤器。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[156]Konstantinides SV, Barco S. Systemic thrombolytic therapy for acute pulmonary embolism: who is a candidate? Semin Respir Crit Care Med. 2017 Feb;38(1):56-65.http://www.ncbi.nlm.nih.gov/pubmed/28208199?tool=bestpractice.com在一些医疗中心,对于接受手术取栓术的患者,会将 IVC 滤器在术中放置或术后立刻放置。[160]Leacche M, Unic D, Goldhaber SZ, et al. Modern surgical treatment of massive pulmonary embolism: Results in 47 consecutive patients after rapid diagnosis and aggressive surgical approach. J Thorac Cardiovasc Surg. 2005 May;129(5):1018-23.http://www.ncbi.nlm.nih.gov/pubmed/15867775?tool=bestpractice.com[161]Aklog L, Williams CS, Byrne JG, et al. Acute pulmonary embolectomy: a contemporary approach. Circulation. 2002 Mar 26;105(12):1416-9.http://circ.ahajournals.org/content/105/12/1416.longhttp://www.ncbi.nlm.nih.gov/pubmed/11914247?tool=bestpractice.com[162]Greelish JP, Leacche M, Solenkova NS, et al. Improved midterm outcomes for type A (central) pulmonary emboli treated surgically. J Thorac Cardiovasc Surg. 2011 Dec;142(6):1423-9.https://www.jtcvs.org/article/S0022-5223(11)00280-7/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/21481423?tool=bestpractice.com
其他相对适应证可包括存在大面积 PE 伴残余深静脉血栓且有进一步 PE 风险、髂股或下腔静脉漂浮血栓、严重心肺疾病和深静脉血栓形成 (DVT)(例如,伴肺动脉高压的肺源性心脏病)。[163]American College of Radiology; Society of Interventional Radiology. ACR-SIR-SPR practice parameter for the performance of inferior vena cava (IVC) filter placement for the prevention of pulmonary embolism. Revised 2016 [internet publication].https://www.acr.org/-/media/ACR/Files/Practice-Parameters/ivc-fliterplacement.pdf?la=en
如果仅可对患者采用放置下腔静脉滤器这一种治疗方法,应尽早进行。关于放置滤器的理想时间的证据非常少。然而,由于此病在发病的 2 个小时内死亡风险最高,[164]Tow DE, Wagner HN. Urokinase pulmonary embolism trial: Phase I results. JAMA. 1970 Dec 21;214(12):2163-72.https://jamanetwork.com/journals/jama/article-abstract/358702 因此可将此作为滤器放置的合理时间窗。观察性研究显示,静脉滤器的放置可减少急性期 PE 相关的死亡率,但可能增加滤器相关静脉血栓栓塞的风险。[165]Stein PD, Matta F, Keyes DC, et al. Impact of vena cava filters on in-hospital case fatality rate from pulmonary embolism. Am J Med. 2012 May;125(5):478-84.https://www.amjmed.com/article/S0002-9343(11)00481-5/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/22310013?tool=bestpractice.com[166]Muriel A, Jiménez D, Aujesky D, et al. Survival effects of inferior vena cava filter in patients with acute symptomatic venous thromboembolism and a significant bleeding risk. J Am Coll Cardiol. 2014 Apr 29;63(16):1675-83.http://www.ncbi.nlm.nih.gov/pubmed/24576432?tool=bestpractice.com
关于永久性 IVC 滤器的并发症较为常见,但罕见有致命性。[166]Muriel A, Jiménez D, Aujesky D, et al. Survival effects of inferior vena cava filter in patients with acute symptomatic venous thromboembolism and a significant bleeding risk. J Am Coll Cardiol. 2014 Apr 29;63(16):1675-83.http://www.ncbi.nlm.nih.gov/pubmed/24576432?tool=bestpractice.com 总体而言,早期并发症(包括放置部位血栓形成)发生于约 10% 的患者。其晚期并发症更为常见,包括 DVT 复发(发生于 20% 的患者)和血栓形成后综合征(发生率高达 40%)。[167]Rajasekhar A, Streiff MB. Vena cava filters for management of venous thromboembolism: a clinical review. Blood Rev. 2013 Sep;27(5):225-41.http://www.ncbi.nlm.nih.gov/pubmed/23932118?tool=bestpractice.com[168]PREPIC Study Group. Eight-year follow-up of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prévention du Risque d'Embolie Pulmonaire par Interruption Cave) randomized study. Circulation. 2005 Jul 19;112(3):416-22.http://circ.ahajournals.org/content/112/3/416.longhttp://www.ncbi.nlm.nih.gov/pubmed/16009794?tool=bestpractice.com 无论抗凝剂使用与否及使用时间长短,患者于 5 年时发生 IVC 阻塞的几率约为 22%,9 年时的发生率约为 33%。[168]PREPIC Study Group. Eight-year follow-up of patients with permanent vena cava filters in the prevention of pulmonary embolism: the PREPIC (Prévention du Risque d'Embolie Pulmonaire par Interruption Cave) randomized study. Circulation. 2005 Jul 19;112(3):416-22.http://circ.ahajournals.org/content/112/3/416.longhttp://www.ncbi.nlm.nih.gov/pubmed/16009794?tool=bestpractice.com
应根据每位患者的相对和绝对禁忌证具体考虑放置滤器后的抗凝治疗。[169]Decousus H, Leizorovicz A, Parent F, et al; Prévention du Risque d'Embolie Pulmonaire par Interruption Cave Study Group. A clinical trial of vena caval filters in the prevention of pulmonary embolism in patients with proximal deep-vein thrombosis. N Engl J Med. 1998 Feb 12;338(7):409-15.https://www.nejm.org/doi/10.1056/NEJM199802123380701http://www.ncbi.nlm.nih.gov/pubmed/9459643?tool=bestpractice.com 如果禁忌证消除或获益风险分析提示治疗方案合理,则应开始抗凝治疗。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com 当使用可回收型滤器时,应在可安全使用抗凝药后尽快移除滤器。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com
不伴休克或低血压的 PE 确诊患者的预后分层
不伴休克或低血压的 PE 确诊患者需要进一步的风险分层,可使用例如肺栓塞严重程度指数 (Pulmonary Embolism Severity Index, PESI) 或简化肺栓塞严重程度指数 (simplified Pulmonary Embolism Severity Index, sPESI) 进行分层。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[85]Konstantinides SV, Barco S, Lankeit M, et al. Management of pulmonary embolism: an update. J Am Coll Cardiol. 2016 Mar 1;67(8):976-90.http://www.onlinejacc.org/content/67/8/976http://www.ncbi.nlm.nih.gov/pubmed/26916489?tool=bestpractice.com
PESI 将不伴休克或低血压的确诊 PE 患者归为 5 类与 30 天死亡率增加有关的风险类别中的 1 类。PESI 的风险分类来源于 11 项临床标准的分值总和;sPESI 仅有 6 项标准,且以二分类的方式报告风险分层(30 天死亡风险低 [0 分] 或高 [≥1 分])。
研究显示,PESI 和 sPESI 预测短期死亡率的准确性相似,但后者更易使用。[170]Vinson DR, Ballard DW, Mark DG, et al; MAPLE Investigators of the KP CREST Network. Risk stratifying emergency department patients with acute pulmonary embolism: does the simplified Pulmonary Embolism Severity Index perform as well as the original? Thromb Res. 2016 Dec;148:1-8.http://www.ncbi.nlm.nih.gov/pubmed/27764729?tool=bestpractice.com[171]Zhou XY, Ben SQ, Chen HL, et al. The prognostic value of pulmonary embolism severity index in acute pulmonary embolism: a meta-analysis. Respir Res. 2012 Dec 4;13:111.https://respiratory-research.biomedcentral.com/articles/10.1186/1465-9921-13-111http://www.ncbi.nlm.nih.gov/pubmed/23210843?tool=bestpractice.com一项 Meta 分析评估了 PESI/sPESI 对于全因死亡率的预后效力,报告的集合敏感度和集合特异度分别为 91% 和 41%。[171]Zhou XY, Ben SQ, Chen HL, et al. The prognostic value of pulmonary embolism severity index in acute pulmonary embolism: a meta-analysis. Respir Res. 2012 Dec 4;13:111.https://respiratory-research.biomedcentral.com/articles/10.1186/1465-9921-13-111http://www.ncbi.nlm.nih.gov/pubmed/23210843?tool=bestpractice.com
基于社会背景和可能的治疗医从性,欧洲心脏病学会 (European Society of Cardiology) 指南建议,对于低风险患者(PESI I 类或 II 类)和 sPESI 评分可能为 0 分的患者,可考虑早期出院并进行院外治疗。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.comPESI 曾在前瞻性试验中用于确认可进行门诊治疗的患者。[172]Roy PM, Moumneh T, Penaloza A, et al. Outpatient management of pulmonary embolism. Thromb Res. 2017 Jul;155:92-100.http://www.ncbi.nlm.nih.gov/pubmed/28525830?tool=bestpractice.com[173]Bledsoe JR, Woller SC, Stevens SM, et al. Management of low-risk pulmonary embolism patients without hospitalization: the Low-Risk Pulmonary Embolism Prospective Management Study. Chest. 2018 Feb 2 [Epub ahead of print].http://www.ncbi.nlm.nih.gov/pubmed/29410163?tool=bestpractice.com
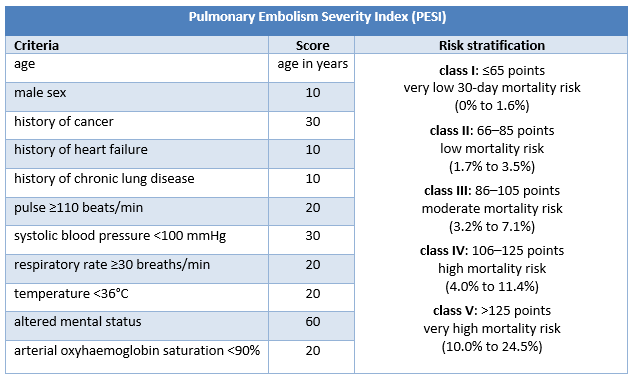 [Figure caption and citation for the preceding image starts]: PESI 标准和风险分层由 BMJ Knowledge Centre 创建 [Citation ends].
[Figure caption and citation for the preceding image starts]: PESI 标准和风险分层由 BMJ Knowledge Centre 创建 [Citation ends].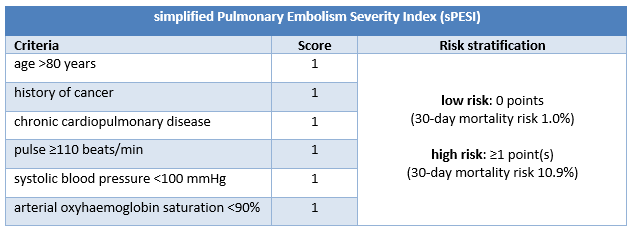 [Figure caption and citation for the preceding image starts]: sPESI 标准和风险分层由 BMJ Knowledge Centre 创建 [Citation ends].
[Figure caption and citation for the preceding image starts]: sPESI 标准和风险分层由 BMJ Knowledge Centre 创建 [Citation ends].
补救性溶栓
对于 PESI 风险分层≥III 或 sPESI ≥1 的患者,应考虑使用超声心动图进行右心室功能评估和心肌肌钙蛋白检测。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com对于不伴休克或低血压的 PE 确诊患者:右心室功能不全可对不良结局有一定预测性,并促使进一步的风险分层;[106]Vanni S, Polidori G, Vergara R, et al. Prognostic value of ECG among patients with acute pulmonary embolism and normal blood pressure. Am J Med. 2009 Mar;122(3):257-64.http://www.ncbi.nlm.nih.gov/pubmed/19272487?tool=bestpractice.com[107]Jaff MR, McMurtry MS, Archer SL, et al. Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension: a scientific statement from the American Heart Association. Circulation. 2011 Apr 26;123(16):1788-830.http://circ.ahajournals.org/content/123/16/1788.longhttp://www.ncbi.nlm.nih.gov/pubmed/21422387?tool=bestpractice.com[108]Weekes AJ, Thacker G, Troha D, et al. Diagnostic accuracy of right ventricular dysfunction markers in normotensive emergency department patients with acute pulmonary embolism. Ann Emerg Med. 2016 Sep;68(3):277-91.http://www.ncbi.nlm.nih.gov/pubmed/26973178?tool=bestpractice.com肌钙蛋白(肌钙蛋白 I 或肌钙蛋白 T)水平升高可导致短期死亡率、PE 所致死亡率和严重不良事件风险有所上升。[174]Bajaj A, Saleeb M, Rathor P, et al. Prognostic value of troponins in acute nonmassive pulmonary embolism: a meta-analysis. Heart Lung. 2015 Jul-Aug;44(4):327-34.http://www.ncbi.nlm.nih.gov/pubmed/25976228?tool=bestpractice.com[175]Becattini C, Vedovati MC, Agnelli G. Prognostic value of troponins in acute pulmonary embolism: a meta-analysis. Circulation. 2007 Jul 24;116(4):427-33.http://circ.ahajournals.org/content/116/4/427.longhttp://www.ncbi.nlm.nih.gov/pubmed/17606843?tool=bestpractice.com在一项纳入了 526 名血压正常的急性 PE 患者的前瞻性实验中,高敏肌钙蛋白 T≥14 pg/mL 对预测 30 天内发生不良结局的敏感度为 87%。[176]Lankeit M, Jiménez D, Kostrubiec M, et al. Predictive value of the high-sensitivity troponin T assay and the simplified Pulmonary Embolism Severity Index in hemodynamically stable patients with acute pulmonary embolism: a prospective validation study. Circulation. 2011 Dec 13;124(24):2716-24.http://circ.ahajournals.org/content/124/24/2716.longhttp://www.ncbi.nlm.nih.gov/pubmed/22082681?tool=bestpractice.com
存在右心室功能不全和心肌肌钙蛋白 I 或 T 检测阳性并且 PESI 风险分层≥III 或 sPESI ≥1 的患者属于中等风险组。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com补救性溶栓可用于中高危患者和已开始抗凝治疗且伴有其他心肺功能损伤表现(例如,心率、呼吸频率、颈静脉压升高)的患者,以及以下患者:[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com[156]Konstantinides SV, Barco S. Systemic thrombolytic therapy for acute pulmonary embolism: who is a candidate? Semin Respir Crit Care Med. 2017 Feb;38(1):56-65.http://www.ncbi.nlm.nih.gov/pubmed/28208199?tool=bestpractice.com
情况恶化,但还未发生低血压
表现出血流动力学失代偿的体征(例如,收缩压<90 mmHg 并持续至少 15 分钟,或收缩压下降至少 40 mmHg 并持续至少 15 分钟且伴有末端器官低灌注的体征)。
对出血风险的考虑也会为溶栓治疗的选择提供依据。
血压正常患者若 PESI 风险分层≥III 或 sPESI ≥1 并且超声心动图和/或心肌肌钙蛋白检测(例如,高敏肌钙蛋白 T<14 pg/mL)正常,则考虑其为中度至低风险。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com对于中度至低风险患者,若其心肌肌钙蛋白为阳性,则应对肌钙蛋白进行监测(即使没有右心室功能障碍);应维持所有中度至低风险患者的抗凝治疗。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com
其他预后指数
RIETE (Registro Informatizado de la Enfermedad TromboEmbolica venosa) 和 HESTIA 标准可能有助于选择能够进行门诊治疗的患者(静脉血栓栓塞发生不良临床结局的风险较低)。[177]Trujillo-Santos J, Lozano F, Lorente MA, et al; RIETE Investigators. A prognostic score to identify low-risk outpatients with acute deep vein thrombosis in the lower limbs. Am J Med. 2015 Jan;128(1):90.e9-15.http://www.ncbi.nlm.nih.gov/pubmed/25242230?tool=bestpractice.com[178]Zondag W, Vingerhoets LM, Durian MF, et al; Hestia Study Investigators. Hestia criteria can safely select patients with pulmonary embolism for outpatient treatment irrespective of right ventricular function. J Thromb Haemost. 2013 Apr;11(4):686-92.https://onlinelibrary.wiley.com/doi/full/10.1111/jth.12146http://www.ncbi.nlm.nih.gov/pubmed/23336721?tool=bestpractice.com[179]Weeda ER, Kohn CG, Peacock WF, et al. External validation of the Hestia criteria for identifying acute pulmonary embolism patients at low risk of early mortality. Clin Appl Thromb Hemost. 2017 Oct;23(7):769-74.http://journals.sagepub.com/doi/pdf/10.1177/1076029616651147http://www.ncbi.nlm.nih.gov/pubmed/27225840?tool=bestpractice.com
临床前研究发现了数个生物标志物(例如,脑利钠肽 [BNP]、N 末端脑钠肽前体 [NT-proBNP]、和心型脂肪酸结合蛋白 [H-FABP]),这些生物标志物可能有助于预测不伴休克或低血压的 PE 确诊患者的临床病程。[131]Jia D, Liu F, Zhang Q, et al. Rapid on-site evaluation of routine biochemical parameters to predict right ventricular dysfunction in and the prognosis of patients with acute pulmonary embolism upon admission to the emergency room. J Clin Lab Anal. 2018 May;32(4):e22362.http://www.ncbi.nlm.nih.gov/pubmed/29160572?tool=bestpractice.com[132]Coutance G, Le Page O, Lo T, et al. Prognostic value of brain natriuretic peptide in acute pulmonary embolism. Crit Care. 2008;12(4):R109.https://ccforum.biomedcentral.com/articles/10.1186/cc6996http://www.ncbi.nlm.nih.gov/pubmed/18721456?tool=bestpractice.com[133]Bajaj A, Rathor P, Sehgal V, et al. Risk stratification in acute pulmonary embolism with heart-type fatty acid-binding protein: a meta-analysis. J Crit Care. 2015 Oct;30(5):1151.e1-7.http://www.ncbi.nlm.nih.gov/pubmed/26111917?tool=bestpractice.com然而还没有充足的证据支持在临床实践中常规使用这些指标。[134]Bajaj A, Rathor P, Sehgal V, et al. Prognostic value of biomarkers in acute non-massive pulmonary embolism: a systematic review and meta-analysis. Lung. 2015 Oct;193(5):639-51.http://www.ncbi.nlm.nih.gov/pubmed/26134045?tool=bestpractice.com
持续进行的抗凝治疗
对于继续抗凝治疗的建议对不同患者组有所不同。在接受长期抗凝治疗的患者中,通常不需要改变初始抗凝药物的选择。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com 继续进行的抗凝治疗时间可能是预先决定的(例如,3 个月)也可为长期的(无预先计划的停止日期)。
持续时间≥6 个月的研究的证据显示,对于 PE 的管理,使用直接口服抗凝药和传统抗凝药并无差异。[180]Robertson L, Kesteven P, McCaslin JE. Oral direct thrombin inhibitors or oral factor Xa inhibitors for the treatment of pulmonary embolism. Cochrane Database Syst Rev. 2015 Dec 4;(12):CD010957.http://cochranelibrary-wiley.com/doi/10.1002/14651858.CD010957.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/26636644?tool=bestpractice.com[181]Becattini C, Agnelli G. Risk stratification and management of acute pulmonary embolism. Hematology Am Soc Hematol Educ Program. 2016 Dec 2;2016(1):404-12.http://asheducationbook.hematologylibrary.org/content/2016/1/404.longhttp://www.ncbi.nlm.nih.gov/pubmed/27913508?tool=bestpractice.com [  ]How do oral direct thrombin inhibitors and oral factor Xa inhibitors compare with standard anticoagulation for the treatment of pulmonary embolism?https://cochranelibrary.com/cca/doi/10.1002/cca.1439/full显示答案对于所有接受长期抗凝药物治疗的患者,应定期(如每年)重新评估抗凝药物的使用。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com
]How do oral direct thrombin inhibitors and oral factor Xa inhibitors compare with standard anticoagulation for the treatment of pulmonary embolism?https://cochranelibrary.com/cca/doi/10.1002/cca.1439/full显示答案对于所有接受长期抗凝药物治疗的患者,应定期(如每年)重新评估抗凝药物的使用。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com
评估出血风险时,应考虑以下因素:[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com 年龄>65 岁、既往出血、癌症、肾衰竭、肝衰竭、血小板减少症、既往卒中、糖尿病、贫血、抗血小板治疗、抗凝控制差、伴功能能力下降的共病、近期手术、频繁跌倒、酒精滥用、使用非甾体抗炎药。
无这些危险因素的患者认为是低风险;有一个危险因素认为患者为中等风险;有两个或更多危险因素,认为患者为高风险。
指南推荐的口服抗凝剂治疗持续时间如下:[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com
手术诱发 PE:3 个月
一过性非手术危险因素诱发 PE:3 个月
无诱因 PE 且伴有低或中度出血风险:长期抗凝治疗(即,无预计停止日期)并进行定期的风险评估,以评价风险/获益比
无诱因 PE 且伴有高出血风险:3 个月。
癌症活跃期
对于伴有活跃恶性肿瘤的 PE 患者,低分子肝素 (LMWH) 是相对于维生素 K 拮抗剂 (VKA)、达比加群、利伐沙班、阿哌沙班或依度沙班而言更佳的选择。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com[182]Lyman GH, Bohlke K, Khorana AA, et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: American Society of Clinical Oncology clinical practice guideline update 2014. J Clin Oncol. 2015 Feb 20;33(6):654-6.http://ascopubs.org/doi/full/10.1200/JCO.2014.59.7351http://www.ncbi.nlm.nih.gov/pubmed/25605844?tool=bestpractice.com [  ]How do low‐molecular‐weight heparin (LMWH), vitamin K agonists (VKAs), and direct oral anticoagulants (DOACs) compare for treatment of venous thromboembolism (VTE) in people with cancer?https://cochranelibrary.com/cca/doi/10.1002/cca.2255/full显示答案欧洲指南推荐为期 3 至 6 个月的抗凝剂治疗。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com美国胸科医师学会 (American College of Chest Physicians, ACCP) 推荐长期抗凝治疗(即,无预计停止日期)。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.comLMWH 在癌症患者中比 VKA 更有效(中等质量证据),对于不宜接受口服治疗(如呕吐)的患者来说疗效更可靠,并且在发生血小板减少症时或需要侵入性干预措施时更易调整/暂停治疗。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com另外,使用 VKA 治疗癌症患者可能很难将其维持在有效血药浓度范围内,因而复发率可能很高。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com
]How do low‐molecular‐weight heparin (LMWH), vitamin K agonists (VKAs), and direct oral anticoagulants (DOACs) compare for treatment of venous thromboembolism (VTE) in people with cancer?https://cochranelibrary.com/cca/doi/10.1002/cca.2255/full显示答案欧洲指南推荐为期 3 至 6 个月的抗凝剂治疗。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com美国胸科医师学会 (American College of Chest Physicians, ACCP) 推荐长期抗凝治疗(即,无预计停止日期)。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.comLMWH 在癌症患者中比 VKA 更有效(中等质量证据),对于不宜接受口服治疗(如呕吐)的患者来说疗效更可靠,并且在发生血小板减少症时或需要侵入性干预措施时更易调整/暂停治疗。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com另外,使用 VKA 治疗癌症患者可能很难将其维持在有效血药浓度范围内,因而复发率可能很高。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com
妊娠
对于具有高风险产后 VTE 的女性,在产后应接受至少 6 周的 LMWH 治疗,并且总治疗持续时间不应低于 3 个月。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[149]Royal College of Obstetricians and Gynaecologists. Reducing the risk of venous thromboembolism during pregnancy and the puerperium. Green-top guideline No. 37a. Apr 2015 [internet publication].https://www.rcog.org.uk/globalassets/documents/guidelines/gtg-37a.pdf其他抗凝剂(包括 VKA),可能会穿过胎盘。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com
VKA 可作为哺乳女性的一种治疗选择。[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com
重度肾功能损伤
ACCP 推荐重度肾功能损伤患者(即,肌酐清除率<30 mL/min)使用 VKA。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com医务人员给肾损伤患者开具直接口服抗凝剂的处方前应参考药物说明和/或当地药典。
肝损伤和凝血障碍
对于此类患者,ACCP 指南推荐使用 LMWH。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com 医务人员给肝损伤的患者开具直接口服抗凝剂的处方前应参考药物说明和/或当地药典。
接受抗凝剂治疗患者出现 VTE 复发
在接受治疗剂量抗凝剂治疗的患者中,VTE 复发并不常见。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com除了明确确定复发性PE的出现之外,还应考虑对抗凝治疗的医从性或者是否存在潜在的恶性肿瘤。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com
ACCP 指南建议,对非 LMWH 抗凝剂医从性较好(或在 VKA 疗法的有效血药浓度范围内)的复发 PE 患者可暂时换用 LMWH(至少 1 个月)。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com对于一直接受 LMWH 治疗的复发 PE 患者,可将 LMWH 的剂量增加(四分之一至三分之一)。[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com
VTE 复发患者
对于不再接受抗凝剂治疗并再次发生无诱因 PE 的患者,指南推荐的抗凝剂治疗持续时间如下:[75]Konstantinides SV, Torbicki A, Agnelli G, et al; Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014 Nov 14;35(43):3033-69.https://academic.oup.com/eurheartj/article/35/43/3033/503581http://www.ncbi.nlm.nih.gov/pubmed/25173341?tool=bestpractice.com[105]Kearon C, Akl EA, Ornelas J, et al; American College of Chest Physicians. Antithrombotic therapy for VTE disease: CHEST guideline and expert panel report. Chest. 2016 Feb;149(2):315-52.https://journal.chestnet.org/article/S0012-3692(15)00335-9/fulltexthttp://www.ncbi.nlm.nih.gov/pubmed/26867832?tool=bestpractice.com
低或中度出血风险:长期抗凝剂治疗并进行定期风险评估以评价风险/获益比
高度出血风险:3 个月。
使用此内容应接受我们的免责声明。
