如果绝经症状已经影响了女性的日常功能和生活质量,需要进行治疗。应向患者说明绝经期的主要症状,并给予关于生活方式改变和药物治疗选择(包括获益和风险)的建议。
在维持症状缓解获益时,即使给予激素治疗,也应尽可能采用最低的剂量和最短的给药时间。由于无法预测症状持续时间,因此激素治疗没有既定的最长持续使用时间;需对所有患者作出个体化决策。应至少每年进行一次重新评估。
潮热的管理
潮热的治疗包括药物治疗(激素和非激素)、非药物治疗(生活方式和替代疗法)或两者结合。
生活方式的改变
尽管证据有限,但是某些生活方式的改变可以提高对症状的耐受性。应鼓励女性适当地减肥及增加运动,这两种方式均可使心血管系统获益,并改善整体健康状况,但可能无法明显改善潮热。
其他自我保健措施包括避免辛辣食物、酒精、咖啡因、热环境和压力。酒精和咖啡因摄入与血管舒缩症状 (VMS) 加重有关。穿着分层的服装、使用手持风扇、喝冷水和使用喷雾瓶可能有益。针对随机对照临床试验的定性综述和 meta 分析显示,瑜伽在短期内可适度缓和心理症状,但不能改善身体症状、血管舒缩症状或泌尿生殖系统症状。[26]Cramer H, Lauche R, Langhorst J, et al. Effectiveness of yoga for menopausal symptoms: a systematic review and meta-analysis of randomized controlled trials. Evid Based Complement Alternat Med. 2012;2012:863905.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3524799/http://www.ncbi.nlm.nih.gov/pubmed/23304220?tool=bestpractice.com
口服雌孕激素联合治疗
对于有子宫的女性,激素疗法应包括一种雌激素和一种孕激素,以防止子宫内膜增生和子宫内膜癌。[14]The 2017 hormone therapy position statement of The North American Menopause Society. Menopause. 2017 Jul;24(7):728-53.http://www.ncbi.nlm.nih.gov/pubmed/28650869?tool=bestpractice.com 雌激素是针对 VMS 最有效的治疗方法,可缓解 80%-90% 的潮热。[27]American College of Obstetricians and Gynecologists. ACOG Practice Bulletin no. 141: management of menopausal symptoms. Obstet Gynecol. 2014 Jan;123(1):202-16.http://www.ncbi.nlm.nih.gov/pubmed/24463691?tool=bestpractice.com
联合治疗方案包括:
持续性联合治疗方案用于闭经超过 12 个月的女性。此方案容易遵循,并且可使绝经期的闭经继续维持。如果女性在接受持续性联合治疗方案的最初 6 个月后有突破性出血,则需要对子宫内膜进行评估(盆腔超声 ± 子宫内膜活检),并考虑转换为序贯疗法,这样患者可以预测出血模式。
序贯治疗方案:在过去 10-14 天的周期中,在雌激素的基础上添加孕激素。序贯激素疗法可作为围绝经期女性的首选治疗,[28]Hamoda H, Panay N, Arya R, et al. The British Menopause Society & Women’s Health Concern 2016 recommendations on hormone replacement therapy in menopausal women. Post Reprod Health. 2016;22(4):165-83.http://journals.sagepub.com/doi/pdf/10.1177/2053369116680501[29]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.https://academic.oup.com/jcem/article/100/11/3975/2836060http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com 但其也可用于绝经后的女性。
单用雌二醇的激素治疗
如果没有全身性雌激素治疗的禁忌证,则没有子宫的女性可仅使用雌激素治疗。[14]The 2017 hormone therapy position statement of The North American Menopause Society. Menopause. 2017 Jul;24(7):728-53.http://www.ncbi.nlm.nih.gov/pubmed/28650869?tool=bestpractice.com [  ]What are the benefits and harms of long-term estrogen-only hormone replacement therapy for healthy postmenopausal women?https://cochranelibrary.com/cca/doi/10.1002/cca.1746/full显示答案
]What are the benefits and harms of long-term estrogen-only hormone replacement therapy for healthy postmenopausal women?https://cochranelibrary.com/cca/doi/10.1002/cca.1746/full显示答案
经皮给药的雌激素治疗
对于血栓形成风险较高(包括体质指数 [BMI]>30)、同时服用其他药物、甘油三酯水平处于临界值、具有胆结石风险或难以坚持每日服药的女性来说,经皮雌激素治疗优于口服雌激素。经皮雌激素由于没有首过效应,与口服雌激素相比,可能降低血栓栓塞的风险,[30]Cobin RH, Goodman NF; AACE Reproductive Endocrinology Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology position statement on menopause - 2017 update. Endocr Pract. 2017 Jul;23(7):869-80.http://journals.aace.com/doi/full/10.4158/EP171828.PShttp://www.ncbi.nlm.nih.gov/pubmed/28703650?tool=bestpractice.com 但这点并无随机对照试验研究证实。经皮雌激素还可能降低恶心的发生率。虽然女性健康计划 (Women's Health Initiative, WHI) 并未专门进行相关研究,但经皮雌激素的长期并发症可能与口服雌激素的相同。根据英国国家卫生与临床优化研究所 (NICE) 的推荐,与基线人群风险相比,使用标准治疗剂量的经皮雌激素不会增加静脉血栓栓塞风险,也不太可能增加卒中风险。[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. November 2015. https://www.nice.org.uk/ (last accessed 14 August 2017).https://www.nice.org.uk/guidance/ng23/
经皮雌激素有贴剂、定量喷雾剂或凝胶剂型可用。一项为期 12 周的多中心 RCT 发现,对于存在中重度潮热的健康绝经期女性,与使用安慰剂相比,经皮雌激素凝胶制剂可使 4 周和 12 周时的潮热频率和严重程度明显降低。[31]Archer DF, Pickar JH, MacAllister DC, et al. Transdermal estradiol gel for the treatment of symptomatic postmenopausal women. Menopause. 2012 Jun;19(6):622-9.http://www.ncbi.nlm.nih.gov/pubmed/22282101?tool=bestpractice.com 其最常报告的副作用包括头痛、感染、乳房疼痛、恶心和失眠。一项网络荟萃分析发现,雌二醇贴片和雌二醇喷雾剂治疗血管舒缩症状的疗效没有差异。[32]Kovács G, Zelei T, Vokó Z. Comparison of efficacy and local tolerability of estradiol metered-dose transdermal spray to estradiol patch in a network meta-analysis. Climacteric. 2016 Oct;19(5):488-95.http://www.ncbi.nlm.nih.gov/pubmed/27593417?tool=bestpractice.com
有完整子宫的女性需要孕激素保护。大多数国家/地区都有可同时提供一种雌激素联合一种孕激素的透皮贴剂。经皮联合序贯 HT 制剂也通常可用。
停用雌激素疗法
尚无充足证据证明停用雌激素治疗的某一种方法优于其他方法。停止激素疗法 (HT) 无年龄标准。应定期对每例患者进行评估(例如一年一次),以确定 HT 的获益程度。对于从 HT 获益程度极小的女性,无论其年龄如何,都可以合理讨论终止治疗。
结合雌激素联合巴多昔芬
许多国家已批准结合雌激素/巴多昔芬(一种选择性雌激素受体调节剂)用于有完整子宫女性的 VMS 治疗和骨质疏松的预防。[33]Tella SH, Gallagher JC. Bazedoxifene + conjugated estrogens in HT for the prevention of osteoporosis and treatment of vasomotor symptoms associated with the menopause. Expert Opin Pharmacother. 2013 Dec;14(17):2407-20.http://www.ncbi.nlm.nih.gov/pubmed/24093499?tool=bestpractice.com 与结合雌激素/甲羟孕酮相比,使用结合雌激素/巴多昔芬治疗的女性出现不良事件显著减少。服用结合雌激素/巴多昔芬的女性不应服用孕激素。
巴多昔芬对乳腺组织有良好的(抗雌激素)作用。[34]Valera MC, Gourdy P, Trémollières F, et al. From the Women's Health Initiative to the combination of estrogen and selective estrogen receptor modulators to avoid progestin addition. Maturitas. 2015 Nov;82(3):274-7.http://www.ncbi.nlm.nih.gov/pubmed/26261036?tool=bestpractice.com 还需要进一步的研究。
生物性激素
生物同质性激素治疗 (bioidentical hormone therapy, BHT) 制剂只是一种根据患者情况配制的复合雌激素制剂(有或无孕激素)。未经调节的复合 BHT 一直被誉为是“天然”且比常规 HT 更安全的疗法,但这些说法未得到证实。
一项系统评价的结论指出,BHT 在治疗中至重度绝经期潮热时比安慰剂更有效(低质量至中等质量的证据),但不良反应率较高。[35]Gaudard AM, Silva de Souza S, Puga ME, et al. Bioidentical hormones for women with vasomotor symptoms. Cochrane Database Syst Rev. 2016 Aug 1;(8):CD010407.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010407.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/27479272?tool=bestpractice.com 尚缺乏与心肌梗死、卒中和乳腺癌等不良结局相关的长期安全性数据。[35]Gaudard AM, Silva de Souza S, Puga ME, et al. Bioidentical hormones for women with vasomotor symptoms. Cochrane Database Syst Rev. 2016 Aug 1;(8):CD010407.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010407.pub2/fullhttp://www.ncbi.nlm.nih.gov/pubmed/27479272?tool=bestpractice.com
一些咨询机构,例如北美更年期学会 (North American Menopause Society)、美国妇产科医师大会 (American Congress of Obstetricians and Gynecologists) 和英国更年期学会 (British Menopause Society) 一般不推荐复合雌激素/孕激素治疗,因为此疗法缺乏标准化的纯度和效能,且存在用药过度或不足的伴随风险。[14]The 2017 hormone therapy position statement of The North American Menopause Society. Menopause. 2017 Jul;24(7):728-53.http://www.ncbi.nlm.nih.gov/pubmed/28650869?tool=bestpractice.com[28]Hamoda H, Panay N, Arya R, et al. The British Menopause Society & Women’s Health Concern 2016 recommendations on hormone replacement therapy in menopausal women. Post Reprod Health. 2016;22(4):165-83.http://journals.sagepub.com/doi/pdf/10.1177/2053369116680501[36]American Congress of Obstetricians and Gynecologists. ACOG committee opinion no. 532: compounded bioidentical menopausal hormone therapy. Obstet Gynecol. 2012 Aug;120(2 Pt 1):411-5.http://www.ncbi.nlm.nih.gov/pubmed/22825109?tool=bestpractice.com 同样,由于缺乏经证实的获益,且有质量控制不良的可能性,美国临床内分泌医师协会 (American Association of Clinical Endocrinologists, AACE) 和美国内分泌学会 (American College of Endocrinology, ACE) 也不推荐使用 BHT。[30]Cobin RH, Goodman NF; AACE Reproductive Endocrinology Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology position statement on menopause - 2017 update. Endocr Pract. 2017 Jul;23(7):869-80.http://journals.aace.com/doi/full/10.4158/EP171828.PShttp://www.ncbi.nlm.nih.gov/pubmed/28703650?tool=bestpractice.com 对于大多数女性来说,获得批准的 HT 可提供适当的治疗且不具有委托制剂的风险。
对于考虑使用更天然制剂的女性,含有雌二醇和微粒化黄体酮的调节制剂(类似卵巢分泌的一种雌激素和一种孕激素)应优先于复方制剂。2017 年 AACE/ACE 立场声明建议,当需要使用黄体酮时,微粒化黄体酮被认为是合成孕激素更安全的替代品。[30]Cobin RH, Goodman NF; AACE Reproductive Endocrinology Scientific Committee. American Association of Clinical Endocrinologists and American College of Endocrinology position statement on menopause - 2017 update. Endocr Pract. 2017 Jul;23(7):869-80.http://journals.aace.com/doi/full/10.4158/EP171828.PShttp://www.ncbi.nlm.nih.gov/pubmed/28703650?tool=bestpractice.com
生物同质性孕激素乳膏是非处方药,但只有 1/3 已发表的随机对照临床试验显示,与安慰剂相比,该药在减少血管舒缩症状方面有一些疗效。[37]Whelan AM, Jurgens TM, Trinacty M. Bioidentical progesterone cream for menopause-related vasomotor symptoms: is it effective? Ann Pharmacother. 2013 Jan;47(1):112-6.http://www.ncbi.nlm.nih.gov/pubmed/23249728?tool=bestpractice.com
激素疗法的风险
向患者提供 HT 的相关获益和风险信息十分重要,这些信息可帮助女性在知情的情况下选择绝经期症状的治疗方法(若有)。 [  ]What are the benefits and harms of long-term combined hormone replacement therapy for healthy postmenopausal women?https://cochranelibrary.com/cca/doi/10.1002/cca.1745/full显示答案 [
]What are the benefits and harms of long-term combined hormone replacement therapy for healthy postmenopausal women?https://cochranelibrary.com/cca/doi/10.1002/cca.1745/full显示答案 [  ]What are the benefits and harms of long-term estrogen-only hormone replacement therapy for healthy postmenopausal women?https://cochranelibrary.com/cca/doi/10.1002/cca.1746/full显示答案
]What are the benefits and harms of long-term estrogen-only hormone replacement therapy for healthy postmenopausal women?https://cochranelibrary.com/cca/doi/10.1002/cca.1746/full显示答案
不同女性之间 HT 使用的相关风险存在差异,具体取决于用药剂量、持续时间、给药途径、开始治疗的年龄以及治疗方案中是否包含孕激素等因素。在 60 岁以下或在绝经 10 年以内的女性(无禁忌证)中,HT 的风险-获益比似乎有利于 VMS 的治疗和骨丢失或骨折的预防。[14]The 2017 hormone therapy position statement of The North American Menopause Society. Menopause. 2017 Jul;24(7):728-53.http://www.ncbi.nlm.nih.gov/pubmed/28650869?tool=bestpractice.com
在两项妇女健康倡议 (Women's Health Initiative) 临床试验为期 18 年的随访中,经 HT 治疗 5-7 年的绝经后女性汇集队列的全因死亡率在 HT 组和安慰剂组之间没有差异(分别为27.1% 和 27.6%;风险比[HR] 0.99,95% 置信区间 [CI] 0.94-1.03])。[38]Manson JE, Aragaki AK, Rossouw JE, et al. Menopausal hormone therapy and long-term all-cause and cause-specific mortality: the women's health initiative randomized trials. JAMA. 2017 Sep 12;318(10):927-38.http://www.ncbi.nlm.nih.gov/pubmed/28898378?tool=bestpractice.com 单纯雌激素 (HR 0.94;95%CI 0.88-1.01) 以及雌激素加孕激素 (HR 1.02;95%CI 0.96-1.08) 均不会增加全因死亡的风险。[38]Manson JE, Aragaki AK, Rossouw JE, et al. Menopausal hormone therapy and long-term all-cause and cause-specific mortality: the women's health initiative randomized trials. JAMA. 2017 Sep 12;318(10):927-38.http://www.ncbi.nlm.nih.gov/pubmed/28898378?tool=bestpractice.com
心脏病、卒中和静脉血栓栓塞
目前并不推荐将激素疗法 (HT) 用于心血管疾病的初级预防。[14]The 2017 hormone therapy position statement of The North American Menopause Society. Menopause. 2017 Jul;24(7):728-53.http://www.ncbi.nlm.nih.gov/pubmed/28650869?tool=bestpractice.com[15]Marjoribanks J, Farquhar C, Roberts H, et al. Long-term hormone therapy for perimenopausal and postmenopausal women. Cochrane Database Syst Rev. 2017 Jan 17;(1):CD004143.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004143.pub5/fullhttp://www.ncbi.nlm.nih.gov/pubmed/28093732?tool=bestpractice.com[16]American Congress of Obstetricians and Gynecologists. ACOG committee opinion no. 565: hormone therapy and heart disease. Obstet Gynecol. 2013 Jun;121(6):1407-10.http://www.acog.org/Resources-And-Publications/Committee-Opinions/Committee-on-Gynecologic-Practice/Hormone-Therapy-and-Heart-Diseasehttp://www.ncbi.nlm.nih.gov/pubmed/23812486?tool=bestpractice.com此外,还需要进一步的研究来评估 HT 开始的时间对冠心病风险和死亡率的影响。
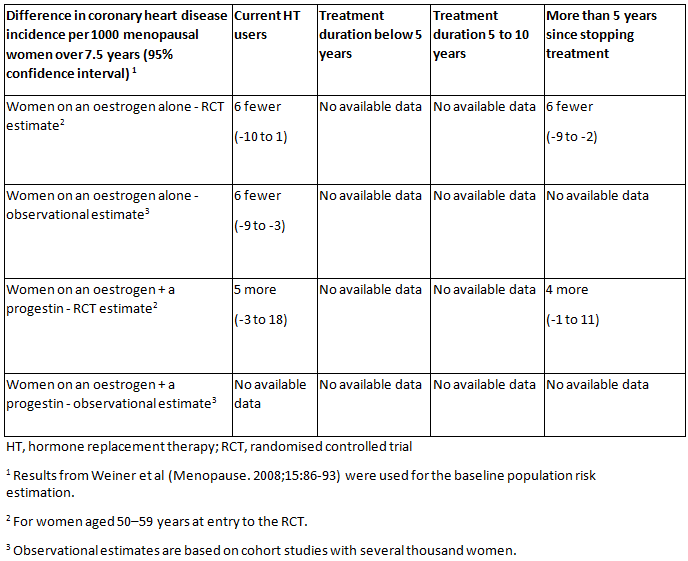 [Figure caption and citation for the preceding image starts]: 与未接受 HT 治疗(或安慰剂)相比,使用不同类型 HT 的冠心病的绝对发生率、使用 HT 的不同持续时间以及绝经期女性自停用 HT 以来的时间。英国国家卫生与临床优化研究所 (NICE)绝经期:诊断和管理2015 年 11 月 [Citation ends].
[Figure caption and citation for the preceding image starts]: 与未接受 HT 治疗(或安慰剂)相比,使用不同类型 HT 的冠心病的绝对发生率、使用 HT 的不同持续时间以及绝经期女性自停用 HT 以来的时间。英国国家卫生与临床优化研究所 (NICE)绝经期:诊断和管理2015 年 11 月 [Citation ends].
静脉血栓栓塞和缺血性卒中的风险随着口服使用 HT 而增加,但 60 岁以下女性的卒中绝对风险很低。[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. November 2015. https://www.nice.org.uk/ (last accessed 14 August 2017).https://www.nice.org.uk/guidance/ng23/[39]de Villiers TJ, Gass ML, Haines CJ, et al. Global consensus statement on menopausal hormone therapy. Climacteric. 2013 Apr;16(2):203-4.http://www.tandfonline.com/doi/full/10.3109/13697137.2013.771520http://www.ncbi.nlm.nih.gov/pubmed/23488524?tool=bestpractice.com[40]de Villiers TJ, Hall JE, Pinkerton JV, et al. Revised global consensus statement on menopausal hormone therapy. Climacteric. 2016 Aug;19(4):313-5.http://www.ncbi.nlm.nih.gov/pubmed/27322027?tool=bestpractice.com 观察性研究和一项 meta 分析表明,与口服雌性激素相比,经皮雌激素治疗的静脉血栓栓塞和卒中风险更低。[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. November 2015. https://www.nice.org.uk/ (last accessed 14 August 2017).https://www.nice.org.uk/guidance/ng23/[14]The 2017 hormone therapy position statement of The North American Menopause Society. Menopause. 2017 Jul;24(7):728-53.http://www.ncbi.nlm.nih.gov/pubmed/28650869?tool=bestpractice.com[39]de Villiers TJ, Gass ML, Haines CJ, et al. Global consensus statement on menopausal hormone therapy. Climacteric. 2013 Apr;16(2):203-4.http://www.tandfonline.com/doi/full/10.3109/13697137.2013.771520http://www.ncbi.nlm.nih.gov/pubmed/23488524?tool=bestpractice.com[40]de Villiers TJ, Hall JE, Pinkerton JV, et al. Revised global consensus statement on menopausal hormone therapy. Climacteric. 2016 Aug;19(4):313-5.http://www.ncbi.nlm.nih.gov/pubmed/27322027?tool=bestpractice.com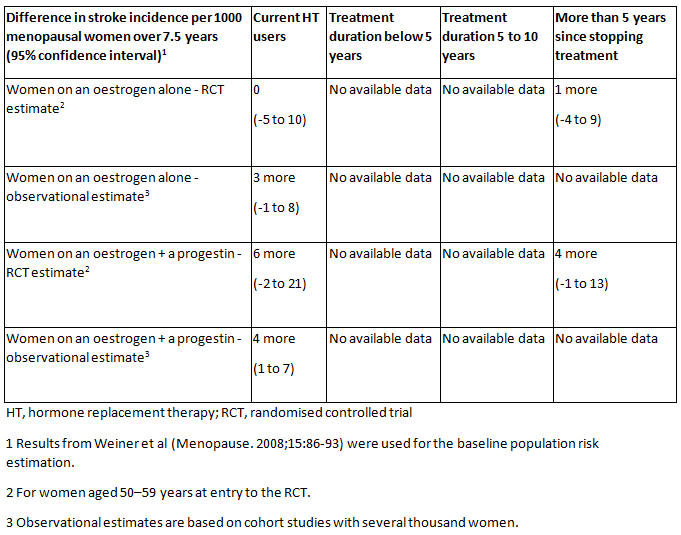 [Figure caption and citation for the preceding image starts]: 与未接受 HT 治疗(或安慰剂)相比,使用不同类型 HT 的冠心病的绝对发生率、使用 HT 的不同持续时间以及绝经期女性自停用 HT 以来的时间。英国国家卫生与临床优化研究所 (NICE)绝经期:诊断和管理2015 年 11 月 [Citation ends].
[Figure caption and citation for the preceding image starts]: 与未接受 HT 治疗(或安慰剂)相比,使用不同类型 HT 的冠心病的绝对发生率、使用 HT 的不同持续时间以及绝经期女性自停用 HT 以来的时间。英国国家卫生与临床优化研究所 (NICE)绝经期:诊断和管理2015 年 11 月 [Citation ends].
乳腺癌和卵巢癌
单纯使用雌激素的激素疗法对乳腺癌的风险影响很小或没有影响。[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. November 2015. https://www.nice.org.uk/ (last accessed 14 August 2017).https://www.nice.org.uk/guidance/ng23/ 孕激素联合雌激素治疗可小幅度升高乳腺癌的风险。[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. November 2015. https://www.nice.org.uk/ (last accessed 14 August 2017).https://www.nice.org.uk/guidance/ng23/[39]de Villiers TJ, Gass ML, Haines CJ, et al. Global consensus statement on menopausal hormone therapy. Climacteric. 2013 Apr;16(2):203-4.http://www.tandfonline.com/doi/full/10.3109/13697137.2013.771520http://www.ncbi.nlm.nih.gov/pubmed/23488524?tool=bestpractice.com[40]de Villiers TJ, Hall JE, Pinkerton JV, et al. Revised global consensus statement on menopausal hormone therapy. Climacteric. 2016 Aug;19(4):313-5.http://www.ncbi.nlm.nih.gov/pubmed/27322027?tool=bestpractice.com 增加的风险与治疗的持续时间有关,在治疗停止后可能消退。[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. November 2015. https://www.nice.org.uk/ (last accessed 14 August 2017).https://www.nice.org.uk/guidance/ng23/[39]de Villiers TJ, Gass ML, Haines CJ, et al. Global consensus statement on menopausal hormone therapy. Climacteric. 2013 Apr;16(2):203-4.http://www.tandfonline.com/doi/full/10.3109/13697137.2013.771520http://www.ncbi.nlm.nih.gov/pubmed/23488524?tool=bestpractice.com[40]de Villiers TJ, Hall JE, Pinkerton JV, et al. Revised global consensus statement on menopausal hormone therapy. Climacteric. 2016 Aug;19(4):313-5.http://www.ncbi.nlm.nih.gov/pubmed/27322027?tool=bestpractice.com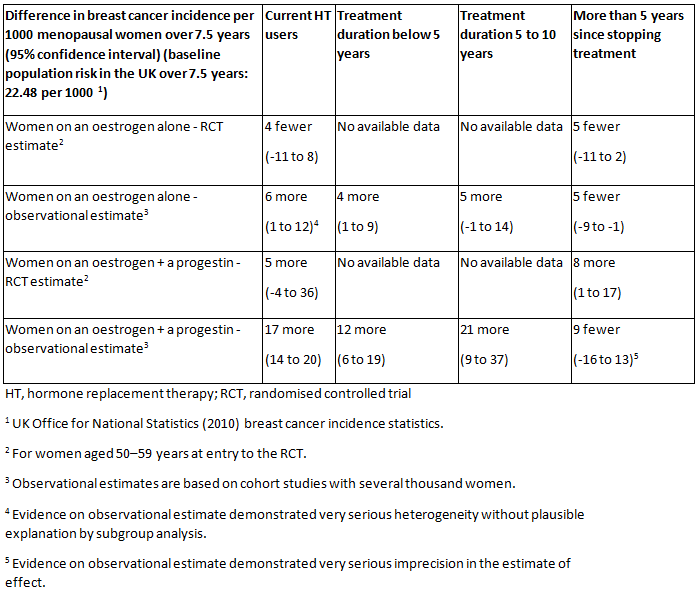 [Figure caption and citation for the preceding image starts]: 与未接受 HT 治疗(或安慰剂)相比,使用不同类型 HT 的冠心病的绝对发生率、使用 HT 的不同持续时间以及绝经期女性自停用 HT 以来的时间。英国国家卫生与临床优化研究所 (NICE)绝经期:诊断和管理2015 年 11 月 [Citation ends].
[Figure caption and citation for the preceding image starts]: 与未接受 HT 治疗(或安慰剂)相比,使用不同类型 HT 的冠心病的绝对发生率、使用 HT 的不同持续时间以及绝经期女性自停用 HT 以来的时间。英国国家卫生与临床优化研究所 (NICE)绝经期:诊断和管理2015 年 11 月 [Citation ends].
有证据表明 HT 可使乳腺组织密度增加。[1]National Institute for Health and Care Excellence. Menopause: diagnosis and management. November 2015. https://www.nice.org.uk/ (last accessed 14 August 2017).https://www.nice.org.uk/guidance/ng23/ 此现象可导致肿瘤检测更加困难,并可能导致一些女性被召回重复进行乳腺 X 线检查和/或进一步评估。
一项纳入 52 项流行病学研究的 meta 分析对 12,110 名绝经后女性的卵巢癌风险进行了分析,其中 55% 的女性曾在某段时间接受 HT 治疗。[41]Beral V, Gaitskell K, Hermon C, et al.; Collaborative Group On Epidemiological Studies Of Ovarian Cancer. Menopausal hormone use and ovarian cancer risk: individual participant meta-analysis of 52 epidemiological studies. Lancet. 2015 May 9;385(9980):1835-42.http://www.ncbi.nlm.nih.gov/pubmed/25684585?tool=bestpractice.com 此 meta 分析表明,HT 治疗 5 年、从 50 岁开始接受治疗将会导致每 1000 名使用者中多出现一例卵巢癌。[41]Beral V, Gaitskell K, Hermon C, et al.; Collaborative Group On Epidemiological Studies Of Ovarian Cancer. Menopausal hormone use and ovarian cancer risk: individual participant meta-analysis of 52 epidemiological studies. Lancet. 2015 May 9;385(9980):1835-42.http://www.ncbi.nlm.nih.gov/pubmed/25684585?tool=bestpractice.com
血管舒缩症状的非激素类药物治疗
一项纳入 43 项非激素疗法临床试验的系统评价和 meta 分析发现,雌激素替代治疗的疗效显著优于非激素替代治疗。[42]Nelson HD, Vesco KK, Haney E, et al. Nonhormonal therapies for menopausal hot flashes: systematic review and meta-analysis. JAMA. 2006 May 3;295(17):2057-71.http://www.ncbi.nlm.nih.gov/pubmed/16670414?tool=bestpractice.com 然而,非激素替代治疗可能会使因危险因素或不能耐受 HT 而无法服用雌激素的女性获益。
选择性 5-羟色胺再摄取抑制剂 (SSRIs) 或 5-羟色胺-去甲肾上腺素再摄取抑制剂 (SNRIs)
对于无法使用 HT 的女性,SSRI 和 SNRI 可有效治疗此类患者的 VMS。[43]Freeman EW, Guthrie KA, Caan B, et al. Efficacy of escitalopram for hot flashes in healthy menopausal women: a randomized controlled trial. JAMA. 2011 Jan 19;305(3):267-74.http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3129746/http://www.ncbi.nlm.nih.gov/pubmed/21245182?tool=bestpractice.com[44]American Academy of Family Physicians. ACOG releases clinical guidelines on management of menopausal symptoms. Am Fam Physician. 2014;90:338-40.http://www.aafp.org/afp/2014/0901/p338.pdf[45]Shams T, Firwana B, Habib F, et al. SSRIs for hot flashes: a systematic review and meta-analysis of randomized trials. J Gen Intern Med. 2014 Jan;29(1):204-13.http://www.ncbi.nlm.nih.gov/pubmed/23888328?tool=bestpractice.com
一些证据表明,艾司西酞普兰可能比其他 SSRIs 能更有效地减少潮热。[45]Shams T, Firwana B, Habib F, et al. SSRIs for hot flashes: a systematic review and meta-analysis of randomized trials. J Gen Intern Med. 2014 Jan;29(1):204-13.http://www.ncbi.nlm.nih.gov/pubmed/23888328?tool=bestpractice.com 目前只有帕罗西汀被批准用于治疗绝经期相关的中、重度 VMS。[27]American College of Obstetricians and Gynecologists. ACOG Practice Bulletin no. 141: management of menopausal symptoms. Obstet Gynecol. 2014 Jan;123(1):202-16.http://www.ncbi.nlm.nih.gov/pubmed/24463691?tool=bestpractice.com[46]Orleans RJ, Li L, Kim MJ, et al. FDA approval of paroxetine for menopausal hot flushes. N Engl J Med. 2014 May 8;370(19):1777-9.http://www.nejm.org/doi/full/10.1056/NEJMp1402080http://www.ncbi.nlm.nih.gov/pubmed/24806158?tool=bestpractice.com
一项涉及 339 例围绝经期和绝经后女性(具有令人困扰的VMS)、为期 8 周的随机对照临床试验证实,与安慰剂相比,文拉法辛(一种 SNRI)将每天出现症状的频率减少了 1.8 次以上 (P = 0.005)。[47]Joffe H, Guthrie KA, LaCroix AZ, et al. Low-dose estradiol and the serotonin-norepinephrine reuptake inhibitor venlafaxine for vasomotor symptoms: a randomized clinical trial. JAMA Intern Med. 2014 Jul;174(7):1058-66.http://archinte.jamanetwork.com/article.aspx?articleid=1876676http://www.ncbi.nlm.nih.gov/pubmed/24861828?tool=bestpractice.com 低剂量雌二醇似乎更有效(与安慰剂相比,每天减少 2.3 次 VMS),但在此研究中没有直接将其与文拉法辛进行比较。[47]Joffe H, Guthrie KA, LaCroix AZ, et al. Low-dose estradiol and the serotonin-norepinephrine reuptake inhibitor venlafaxine for vasomotor symptoms: a randomized clinical trial. JAMA Intern Med. 2014 Jul;174(7):1058-66.http://archinte.jamanetwork.com/article.aspx?articleid=1876676http://www.ncbi.nlm.nih.gov/pubmed/24861828?tool=bestpractice.com 在无法服用雌激素的女性中,文拉法辛可能是合理的替代治疗选择。
一项涉及 365 例绝经后女性(伴有令人困扰的 VMS)的随机对照临床试验表明,与安慰剂相比,去甲文拉法辛 (desvenlafaxine;是一种 SNRI)能够降低 12 个月期间中至重度潮热的发生频率和严重性。[48]Pinkerton JV, Archer DF, Guico-Pabia CJ, et al. Maintenance of the efficacy of desvenlafaxine in menopausal vasomotor symptoms: a 1-year randomized controlled trial. Menopause. 2013 Jan;20(1):38-46.http://www.ncbi.nlm.nih.gov/pubmed/23266839?tool=bestpractice.com 在此之后人们对去甲文拉法辛用于此类患者人群中的安全性问题表示担忧,而一项离散性安全性分析发现,与安慰剂相比,没有证据显示使用去甲文拉法辛治疗绝经期 VMS 会增加患者心血管、脑血管或肝脏事件的风险。[49]Archer DF, Pinkerton JV, Guico-Pabia CJ, et al. Cardiovascular, cerebrovascular, and hepatic safety of desvenlafaxine for 1 year in women with vasomotor symptoms associated with menopause. Menopause. 2013 Jan;20(1):47-56.http://www.ncbi.nlm.nih.gov/pubmed/23266840?tool=bestpractice.com
加巴喷丁
研究表明,加巴喷丁对潮热有一定的治疗效果。[29]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.https://academic.oup.com/jcem/article/100/11/3975/2836060http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com[50]Hayes LP, Carroll DG, Kelley KW. Use of gabapentin for the management of natural or surgical menopausal hot flashes. Ann Pharmacother. 2011 Mar;45(3):388-94.http://www.ncbi.nlm.nih.gov/pubmed/21343402?tool=bestpractice.com 但常有嗜睡、头晕和不稳等不良反应的报告。[50]Hayes LP, Carroll DG, Kelley KW. Use of gabapentin for the management of natural or surgical menopausal hot flashes. Ann Pharmacother. 2011 Mar;45(3):388-94.http://www.ncbi.nlm.nih.gov/pubmed/21343402?tool=bestpractice.com 日间使用加巴喷丁可能会导致患者出现无法忍受的嗜睡。[29]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.https://academic.oup.com/jcem/article/100/11/3975/2836060http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com
可乐定
可乐定是一种降压药,可减少潮热,但其有效性可能低于 SSRIs/SNRIs 和加巴喷丁。[29]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.https://academic.oup.com/jcem/article/100/11/3975/2836060http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com 低血压可能是限制可乐定治疗的不良反应。[51]Goldberg RM, Loprinzi CL, O'Fallon JR, et al. Transdermal clonidine for ameliorating tamoxifen-induced hot flashes. J Clin Oncol. 1994 Jan;12(1):155-8.http://www.ncbi.nlm.nih.gov/pubmed/8270972?tool=bestpractice.com 在治疗期间和停药后均需监测血压(以防反弹)。经皮贴剂可使血液水平稳定,并优于口服可乐定制剂。[29]Stuenkel CA, Davis SR, Gompel A, et al. Treatment of symptoms of the menopause: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2015 Nov;100(11):3975-4011.https://academic.oup.com/jcem/article/100/11/3975/2836060http://www.ncbi.nlm.nih.gov/pubmed/26444994?tool=bestpractice.com
泌尿生殖道萎缩的症状
在有泌尿生殖道萎缩症状的女性中,可以考虑使用低剂量阴道雌激素制剂。[14]The 2017 hormone therapy position statement of The North American Menopause Society. Menopause. 2017 Jul;24(7):728-53.http://www.ncbi.nlm.nih.gov/pubmed/28650869?tool=bestpractice.com
一篇 Medline 和 Cochrane 数据库的综述显示,与安慰剂相比,阴道雌激素能更有效地改善干燥,减少性交疼痛、尿急和尿频。[52]Rahn DD, Carberry C, Sanses TV, et al.; Society of Gynecologic Surgeons Systematic Review Group. Vaginal estrogen for genitourinary syndrome of menopause: a systematic review. Obstet Gynecol. 2014 Dec;124(6):1147-56.http://www.ncbi.nlm.nih.gov/pubmed/25415166?tool=bestpractice.com 尿路感染率也随阴道雌激素的使用而下降。除了使用高剂量结合马雌激素 (CEE) 乳膏的患者之外,血清雌二醇水平均保持在绝经后正常范围以内。[52]Rahn DD, Carberry C, Sanses TV, et al.; Society of Gynecologic Surgeons Systematic Review Group. Vaginal estrogen for genitourinary syndrome of menopause: a systematic review. Obstet Gynecol. 2014 Dec;124(6):1147-56.http://www.ncbi.nlm.nih.gov/pubmed/25415166?tool=bestpractice.com
对于没有激素依赖性癌症病史的女性,为缓解症状,可持续在阴道局部使用雌激素,尚没有证据支持推荐行子宫内膜监测。[23]North American Menopause Society. Management of symptomatic vulvovaginal atrophy: 2013 position statement of the North American Menopause Society. Menopause. 2013;20:888-902;quiz 903-904.http://www.menopause.org/docs/default-source/2013/vva-position-statement.pdf?sfvrsn=0http://www.ncbi.nlm.nih.gov/pubmed/23985562?tool=bestpractice.com 妇女健康倡议的观察性研究发现,在使用阴道雌激素的女性和未使用该治疗的女性中,两类人群患心血管疾病、侵袭性乳腺癌和子宫内膜癌的风险没有差异。[53]Crandall CJ, Hovey KM, Andrews CA, et al. Breast cancer, endometrial cancer, and cardiovascular events in participants who used vaginal estrogen in the Women's Health Initiative Observational Study. Menopause. 2018 Jan;25(1):11-20.http://www.ncbi.nlm.nih.gov/pubmed/28816933?tool=bestpractice.com
接受外用阴道雌激素治疗的患者,不需要辅以孕激素。阴道雌二醇片不会引起显著的全身性吸收,并可根据需要长期使用。尚无证据表明某种阴道内雌激素制剂比另一种更为有效。[54]Lethaby A, Ayeleke RO, Roberts H. Local oestrogen for vaginal atrophy in postmenopausal women. Cochrane Database Syst Rev. 2016 Aug 31;(8):CD001500.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001500.pub3/fullhttp://www.ncbi.nlm.nih.gov/pubmed/27577677?tool=bestpractice.com
奥培米芬 (Ospemifene ) 是一种选择性雌激素受体调节剂,适用于治疗绝经后女性的性交疼痛。一项 III 期临床试验显示,与安慰剂相比,奥培米芬增加了表面细胞的百分比,减轻了性交疼痛。[55]Portman DJ, Bachmann GA, Simon JA. Ospemifene, a novel selective estrogen receptor modulator for treating dyspareunia associated with postmenopausal vulvar and vaginal atrophy. Menopause. 2013 Jun;20(6):623-30.http://www.ncbi.nlm.nih.gov/pubmed/23361170?tool=bestpractice.com 潮热是最常报告的不良事件(奥培米芬治疗组与安慰剂组的发生率分别为 7% 和 4%)。[55]Portman DJ, Bachmann GA, Simon JA. Ospemifene, a novel selective estrogen receptor modulator for treating dyspareunia associated with postmenopausal vulvar and vaginal atrophy. Menopause. 2013 Jun;20(6):623-30.http://www.ncbi.nlm.nih.gov/pubmed/23361170?tool=bestpractice.com[56]Palacios S, Cancelo MJ. Clinical update on the use of ospemifene in the treatment of severe symptomatic vulvar and vaginal atrophy. Int J Womens Health. 2016 Oct 26;8:617-26.https://www.dovepress.com/clinical-update-on-the-use-of-ospemifene-in-the-treatment-of-severe-sy-peer-reviewed-fulltext-article-IJWHhttp://www.ncbi.nlm.nih.gov/pubmed/27822125?tool=bestpractice.com
乳腺癌和妇科肿瘤幸存者
乳腺癌后绝经症状管理的专家共识建议包括:[57]Santen RJ, Stuenkel CA, Davis SR, et al. Managing menopausal symptoms and associated clinical issues in breast cancer survivors. J Clin Endocrinol Metab. 2017 Oct 1;102(10):3647-61.http://www.ncbi.nlm.nih.gov/pubmed/28934376?tool=bestpractice.com
一般避免使用绝经期全身性激素疗法或阴道雌激素疗法*
实施生活方式措施(例如,健康饮食、定期进行体育活动、戒烟、减肥、限制或避免饮酒、保持充分的维生素 D 和钙的水平)
非激素、药理学治疗(例如,选择性5-羟色胺/去甲肾上腺素再摄取抑制剂)和/或认知行为疗法。
*有数据显示,HT 不会增加无雌激素依赖性恶性肿瘤女性的复发风险。[58]Del Carmen MG, Rice LW. Management of menopausal symptoms in women with gynecologic cancers. Gynecol Oncol. 2017 Aug;146(2):427-35.http://www.ncbi.nlm.nih.gov/pubmed/28625396?tool=bestpractice.com[59]O'Donnell RL, Clement KM, Edmondson RJ. Hormone replacement therapy after treatment for a gynaecological malignancy. Curr Opin Obstet Gynecol. 2016 Feb;28(1):32-41.http://www.ncbi.nlm.nih.gov/pubmed/26626038?tool=bestpractice.com 一项综述表明,对于没有患雌二醇依赖性恶性肿瘤的妇科肿瘤患者,短期使用 HT 可能会改善其绝经期血管舒缩和泌尿生殖系症状。[60]Del Carmen MG, Rice LW. Management of menopausal symptoms in women with gynecologic cancers. Gynecol Oncol. 2017 Aug;146(2):427-35.http://www.ncbi.nlm.nih.gov/pubmed/28625396?tool=bestpractice.com 对于患非雌二醇依赖性恶性肿瘤的女性,雌激素的使用必须根据患者的情况进行调整。
聚卡波非凝胶是一种阴道保湿霜,也可作为阴道萎缩症状(包括阴道干涩及性交疼痛)的有效治疗药物。[61]Goetsch MF, Lim JY, Caughey AB. Locating pain in breast cancer survivors experiencing dyspareunia: a randomized controlled trial. Obstet Gynecol. 2014 Jun;123(6):1231-6.http://www.ncbi.nlm.nih.gov/pubmed/24807329?tool=bestpractice.com[62]Society of Obstetricians and Gynaecologists of Canada. Managing menopause. September 2014 [internet publication].http://sogc.org/wp-content/uploads/2014/09/gui311CPG1409Eabstract1.pdf 由于雌激素缺乏会导致阴道萎缩和干燥,因此性交疼痛在乳腺癌幸存者中很常见。一项小型临床试验结果显示,与正常生理盐水相比,利多卡因可减少伴有性交痛的绝经后乳腺癌患者的外阴前庭压痛(以 10 分制进行评分,中位性交痛评分为 8 分)。[61]Goetsch MF, Lim JY, Caughey AB. Locating pain in breast cancer survivors experiencing dyspareunia: a randomized controlled trial. Obstet Gynecol. 2014 Jun;123(6):1231-6.http://www.ncbi.nlm.nih.gov/pubmed/24807329?tool=bestpractice.com 阴道脱氢表雄酮 (DHEA) 和口服奥培米芬被批准用于性交痛的治疗,但其对乳腺癌后的安全性问题尚未得到研究证实。[57]Santen RJ, Stuenkel CA, Davis SR, et al. Managing menopausal symptoms and associated clinical issues in breast cancer survivors. J Clin Endocrinol Metab. 2017 Oct 1;102(10):3647-61.http://www.ncbi.nlm.nih.gov/pubmed/28934376?tool=bestpractice.com
性欲减退
对于有痛苦的性欲低下和疲劳的女性,特别是对雌激素联合或不联合孕激素治疗无效的患者,医生应告知雄激素补充是一种可选的治疗方式。
内分泌学会 (Endocrine Society) 推荐不对健康的绝经期女性给予雄激素缺乏症的诊断,因为目前还没有明确定义的综合征并且缺乏有关雄激素水平伴有特异性体征或症状的相关数据。[63]Wierman ME, Arlt W, Basson R, et al. Androgen therapy in women: a reappraisal: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2014 Oct;99(10):3489-510.https://academic.oup.com/jcem/article/99/10/3489/2836272http://www.ncbi.nlm.nih.gov/pubmed/25279570?tool=bestpractice.com 有性功能障碍的绝经后女性(继发于机能减退的性欲障碍)可考虑使用睾酮替代治疗。[63]Wierman ME, Arlt W, Basson R, et al. Androgen therapy in women: a reappraisal: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2014 Oct;99(10):3489-510.https://academic.oup.com/jcem/article/99/10/3489/2836272http://www.ncbi.nlm.nih.gov/pubmed/25279570?tool=bestpractice.com 然而,当前关于睾酮长期治疗的有效性和安全性的数据有限,依据睾酮水平,不能预测治疗效果,因此不应进行常规睾酮水平检测,但监测雄激素过多的体征很重要。[63]Wierman ME, Arlt W, Basson R, et al. Androgen therapy in women: a reappraisal: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2014 Oct;99(10):3489-510.https://academic.oup.com/jcem/article/99/10/3489/2836272http://www.ncbi.nlm.nih.gov/pubmed/25279570?tool=bestpractice.com
因为缺乏长期睾酮治疗的安全性数据,应该由具有该药使用经验的临床医生启动该治疗。治疗期间仔细监测和随诊至关重要。[63]Wierman ME, Arlt W, Basson R, et al. Androgen therapy in women: a reappraisal: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2014 Oct;99(10):3489-510.https://academic.oup.com/jcem/article/99/10/3489/2836272http://www.ncbi.nlm.nih.gov/pubmed/25279570?tool=bestpractice.com
压力性尿失禁
盆底康复锻炼可用于治疗压力性尿失禁。一项研究显示,被随机分配接受阴道内雌三醇联合盆底康复治疗的绝经后女性中,经 6 个月治疗的患者中有 73.4% 在压力性尿失禁方面有主观改善,而对照组中得到改善的患者只占到 9.71%。[64]Capobianco G, Donolo E, Borghero G, et al. Effects of intravaginal estriol and pelvic floor rehabilitation on urogenital aging in postmenopausal women. Arch Gynecol Obstet. 2012 Feb;285(2):397-403.http://www.ncbi.nlm.nih.gov/pubmed/21706345?tool=bestpractice.com 但两组女性的泌尿生殖道萎缩的体征和症状均有改善。
睡眠障碍和情绪症状
失眠、夜间躁动或易醒是绝经期的常见问题。失眠常与潮热相关(其他相关影响因素还包括抑郁或睡眠呼吸暂停)。但尚无研究证实睡眠障碍与绝经有直接的生理学上的关联。
一些女性报告激素治疗期间睡眠有所改善。[65]Freedman RR. Pathophysiology and treatment of menopausal hot flashes. Semin Reprod Med. 2005 May;23(2):117-25.http://www.ncbi.nlm.nih.gov/pubmed/15852197?tool=bestpractice.com 一项针对 11 项质量不同的研究的系统评价显示,黄体酮可改善血管舒缩症状和睡眠质量。[66]Spark MJ, Willis J. Systematic review of progesterone use by midlife and menopausal women. Maturitas. 2012 Jul;72(3):192-202.http://www.ncbi.nlm.nih.gov/pubmed/22541358?tool=bestpractice.com
有数据显示,在绝经过渡期和绝经早期短期使用 HT 可能改善患者的情绪和抑郁症状,但研究结果不一致。[67]Gordon JL, Girdler SS. Hormone replacement therapy in the treatment of perimenopausal depression. Curr Psychiatry Rep. 2014 Dec;16(12):517.http://www.ncbi.nlm.nih.gov/pubmed/25308388?tool=bestpractice.com[68]Veerus P, Hovi SL, Sevón T, et al. The effect of hormone therapy on women's quality of life in the first year of the Estonian Postmenopausal Hormone Therapy trial. BMC Res Notes. 2012 Apr 3;5:176.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3349465/http://www.ncbi.nlm.nih.gov/pubmed/22472039?tool=bestpractice.com 此外,还有证据显示,在乳腺癌治疗后有绝经期症状的女性中,认知行为疗法对情绪低落和焦虑的管理有益。[69]Mann E, Smith MJ, Hellier J, et al. Cognitive behavioural treatment for women who have menopausal symptoms after breast cancer treatment (MENOS 1): a randomised controlled trial. Lancet Oncol. 2012 Mar;13(3):309-18.https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3314999/http://www.ncbi.nlm.nih.gov/pubmed/22340966?tool=bestpractice.com尽管目前缺乏专门用于治疗女性抑郁患者(与早期绝经有关)认知行为疗法 (CBT) 的高质量证据,但鉴于危害风险较低,以及对普通人群抑郁症的治疗存在较强的证据基础,此疗法对于围绝经期抑郁女性来说是一种合理选择。 [70]Maki PM, Kornstein SG, Joffe H, Bromberger JT, Freeman EW, Athappilly G, Bobo WV, Rubin LH, Koleva HK, Cohen LS, Soares CN; Board of Trustees for The North American Menopause Society (NAMS) and the Women and Mood Disorders Task Force of the National Network of Depression Centers. Guidelines for the evaluation and treatment of perimenopausal depression: summary and recommendations. Menopause. 2018 Oct;25(10):1069-1085.https://journals.lww.com/menopausejournal/Fulltext/2018/10000/Guidelines_for_the_evaluation_and_treatment_of.5.aspxhttp://www.ncbi.nlm.nih.gov/pubmed/30179986?tool=bestpractice.com
即使激素治疗或其他替代疗法可能会改善睡眠模式,仍需对其他潜在因素进行仔细评估,以便予以有针对性的治疗。心境障碍,尤其是抑郁症,经常可因激素治疗而改善,但是传统的抗抑郁药物治疗可能更有效。[71]Cohen LS, Soares CN, Joffe H. Diagnosis and management of mood disorders during the menopausal transition. Am J Med. 2005 Dec 19;118(suppl 12B):93-7.http://www.ncbi.nlm.nih.gov/pubmed/16414333?tool=bestpractice.com 有严重抑郁症状的女性应转诊进行心理健康评估。
其他治疗或草药治疗
一篇针对 43 项均涉及植物雌激素的随机对照临床试验 (RCT) 的 Cochrane 综述显示:在大多数的临床试验中,植物雌激素起到了巨大的安慰剂效应(从 1% 到 59%)。[72]Lethaby A, Marjoribanks J, Kronenberg F, et al. Phytoestrogens for menopausal vasomotor symptoms. Cochrane Database Syst Rev. 2013 Dec 10;(12):CD001395.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001395.pub4/fullhttp://www.ncbi.nlm.nih.gov/pubmed/24323914?tool=bestpractice.com 该综述以及其他综述均未发现植物雌激素(包括异黄酮)对治疗绝经期 VMS 有效的确凿证据。[27]American College of Obstetricians and Gynecologists. ACOG Practice Bulletin no. 141: management of menopausal symptoms. Obstet Gynecol. 2014 Jan;123(1):202-16.http://www.ncbi.nlm.nih.gov/pubmed/24463691?tool=bestpractice.com[72]Lethaby A, Marjoribanks J, Kronenberg F, et al. Phytoestrogens for menopausal vasomotor symptoms. Cochrane Database Syst Rev. 2013 Dec 10;(12):CD001395.https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001395.pub4/fullhttp://www.ncbi.nlm.nih.gov/pubmed/24323914?tool=bestpractice.com[73]Sacks FM, Lichtenstein A, Van Horn L, et al; American Heart Association Nutrition Committee. Soy protein, isoflavones, and cardiovascular health: an American Heart Association Science Advisory for professionals from the Nutrition Committee. Circulation. 2006 Feb 21;113(7):1034-44.http://circ.ahajournals.org/content/113/7/1034.longhttp://www.ncbi.nlm.nih.gov/pubmed/16418439?tool=bestpractice.com
与安慰剂相比,针灸疗法和反射疗法未显著改善 VMS。[27]American College of Obstetricians and Gynecologists. ACOG Practice Bulletin no. 141: management of menopausal symptoms. Obstet Gynecol. 2014 Jan;123(1):202-16.http://www.ncbi.nlm.nih.gov/pubmed/24463691?tool=bestpractice.com
 ] [
] [  ]
] [Figure caption and citation for the preceding image starts]: 与未接受 HT 治疗(或安慰剂)相比,使用不同类型 HT 的冠心病的绝对发生率、使用 HT 的不同持续时间以及绝经期女性自停用 HT 以来的时间。英国国家卫生与临床优化研究所 (NICE)绝经期:诊断和管理2015 年 11 月 [Citation ends].
[Figure caption and citation for the preceding image starts]: 与未接受 HT 治疗(或安慰剂)相比,使用不同类型 HT 的冠心病的绝对发生率、使用 HT 的不同持续时间以及绝经期女性自停用 HT 以来的时间。英国国家卫生与临床优化研究所 (NICE)绝经期:诊断和管理2015 年 11 月 [Citation ends]. [Figure caption and citation for the preceding image starts]: 与未接受 HT 治疗(或安慰剂)相比,使用不同类型 HT 的冠心病的绝对发生率、使用 HT 的不同持续时间以及绝经期女性自停用 HT 以来的时间。英国国家卫生与临床优化研究所 (NICE)绝经期:诊断和管理2015 年 11 月 [Citation ends].
[Figure caption and citation for the preceding image starts]: 与未接受 HT 治疗(或安慰剂)相比,使用不同类型 HT 的冠心病的绝对发生率、使用 HT 的不同持续时间以及绝经期女性自停用 HT 以来的时间。英国国家卫生与临床优化研究所 (NICE)绝经期:诊断和管理2015 年 11 月 [Citation ends]. [Figure caption and citation for the preceding image starts]: 与未接受 HT 治疗(或安慰剂)相比,使用不同类型 HT 的冠心病的绝对发生率、使用 HT 的不同持续时间以及绝经期女性自停用 HT 以来的时间。英国国家卫生与临床优化研究所 (NICE)绝经期:诊断和管理2015 年 11 月 [Citation ends].
[Figure caption and citation for the preceding image starts]: 与未接受 HT 治疗(或安慰剂)相比,使用不同类型 HT 的冠心病的绝对发生率、使用 HT 的不同持续时间以及绝经期女性自停用 HT 以来的时间。英国国家卫生与临床优化研究所 (NICE)绝经期:诊断和管理2015 年 11 月 [Citation ends].