病因学
G6PD的基因定位于X染色体的长臂末端。因此酶缺乏将见于杂合子的男性(唯一的一条X染色体上存在突变)和纯合子的女性(两条X染色体上都有突变),这在大多数X染色体连锁的疾病中很少见,但在G6PD缺乏症的人群中却很常见(如非洲)。
G6PD基因突变的普遍性可能是由于G6PD等位基因缺失可以抵御恶性疟原虫(与在镰状细胞贫血和地中海贫血中看到的相似)的侵袭,从而对机体起到保护作用。保护机制的确切机理仍不明确。支持的证据是来自对人群的研究,后者表明全球G6PD等位基因缺失的分布类似于疟疾的全球分布。[4]此外,一项临床研究表明,特异突变的出现(如G6PDA-等位基因)使患恶性疟疾的风险下降了46%-58%。[9]体外研究表明,在杂合子女性中,正常红细胞感染疟原虫的概率比G6PD缺失红细胞大2-80倍。[4]
杂合子女性在遗传学上为嵌合体:她们有一半的细胞是正常的,另外一半则是完全缺乏G6PD。她们的症状通常比较轻微,但有时也会发生严重的急性溶血。基因的突变将导致氨基酸替换(或者偶然的小的缺失),酶结构的改变,导致酶活性降低。现已发现大约160种突变,数目远远少于先前已经被描述的生物化学变异体。许多的这类变异体似乎独立地出现在世界的不同地区,而目前已知在分子水平是完全一样的。[10]结构与功能的关系是由临床的对应关系来定义的。因此,导致第I类变异的突变将产生不稳定得多的酶,并且与显著下降的活性有关,而导致第III和IV类变异体的突变则与酶活性更多的保留有关。[3][11]
常见的特殊遗传变异包括:
地中海型G6PD:一种II型的变异体,影响地中海周边的欧洲和阿拉伯国家人群(或他们的后代)
A-型G6PD:一种III类变异体,影响撒哈拉以南的非洲人群(或他们的后代)
马希多型(III类)以及联合型(II类):广泛影响亚洲人群
病理生理学
所有细胞都需要G6PD来保护他们免受氧化物的伤害。G6PD在磷酸戊糖途径中将催化第一步的反应,在该反应中,葡萄糖-6-硫酸盐被氧化为6-磷酸葡萄糖酸盐。这个反应与将NADP(烟酰胺腺嘌呤磷酸)还原为NADPH(烟酰胺腺嘌呤二核苷磷酸)有关,后者被用来产生还原型的谷胱甘肽。
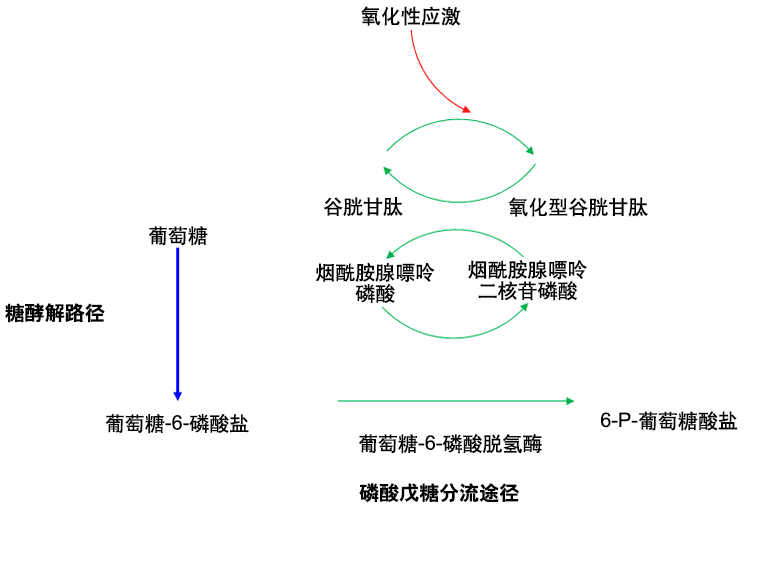 [Figure caption and citation for the preceding image starts]: G6PD在磷酸戊糖途径里的作用是导致NADPH和GSH的产生,产物被用于保护红细胞免受氧化应激。改编自Haematology at a Glance,Mehta AB和Hoffbrand AV,第三版,Wiley Blackwell 2007;经允许后使用 [Citation ends].
[Figure caption and citation for the preceding image starts]: G6PD在磷酸戊糖途径里的作用是导致NADPH和GSH的产生,产物被用于保护红细胞免受氧化应激。改编自Haematology at a Glance,Mehta AB和Hoffbrand AV,第三版,Wiley Blackwell 2007;经允许后使用 [Citation ends].
对红细胞而言,这是防止氧化伤害的唯一来源,红血细胞持续不断地受到由氧合血红蛋白转化为去氧血红蛋白时产生的自由基形式的氧化剂和吞噬粒细胞产生的过氧化物形式的氧化剂的刺激。正常的红细胞对于氧化应激产生应答时可以增加NADPH的产生,G6PD缺乏症患者不具备应对氧化应激的能力。缺乏应对氧化应激的能力会导致血红蛋白中的巯基键及细胞膜遭到破坏,从而导致溶血。其他组织器官中的细胞通过旁路可以产生NADPH,因此可以抵抗患者的氧化压力。相反,红细胞的代谢极其简单,它们缺乏细胞核和线粒体,无法进行蛋白质合成,只能专一地将葡萄糖用于ATP的合成。所有红细胞酶的活性,包括G6PD,在年幼的红细胞(网状细胞)中含量最高,并随细胞变老而逐渐降低。
溶血发生之后,红细胞产生的速率会增加,年幼红细胞比例的增加将带来高水平的G6PD,从而限制了红细胞的进一步裂解。溶血发生也因此常常在中度缺乏(III类)突变体(例如G6PD A-)中是自限性的,但在严重缺乏(II类)突变体的患者中则可能导致更加严重贫血。
完全缺乏这种酶将无法生存。偶尔,具有I类变异体的男性患者将具有严重偏低的G6PD活性,以至于其红细胞在持续不断地溶解(慢性非球形红细胞溶血性贫血)。然而,几乎所有有缺陷的个体都有某种多态性酶变异体(如地中海地区G6PD属于II类,或者G6PD A-属于III类),可以给这类人群一些残存的能力,使他们在无应激的状态下无任何症状。然而,受到氧化应激的刺激时(如摄入某些药物,接触蚕豆中的某些化学物质或苷类以及感染等),红细胞将发生裂解。
有些药物据知会对红细胞产生氧化应激作用,并在G6PD缺乏症的患者中引起溶血性贫血。就某些药物(如氨苯砜、伯氨喹、磺胺类)而言,这种联系是清晰而稳定的。而在几乎所有的患者中都会观察到溶血,不论是否具有残余的酶活性。[2][11][12][13] 对于其他药物(如阿司匹林),该临床相关性没有如此稳定一致,反映出先天(如剩余酶活性和药物代谢动力学)和后天获得性(如剂量、吸收与药物代谢、并存的感染)因素的相互作用。[2][11] 在拉丁美洲,伯氨喹诱导的溶血症的重要性已经非常明显。[14]一份综述曾经强调,许多化合物被错误的认为会引起溶血症,是因为这些化合物被用于了与感染有关的溶血患者。[15]此综述仅突出显示了 7 种当前使用药物的溶血可能性,即氨苯砜、亚甲基蓝、呋喃妥因、非那吡啶、伯氨喹、拉布立酶以及甲苯胺蓝。 [Figure caption and citation for the preceding image starts]: 已知会引起G6PD缺乏症患者发生溶血的药物和物质由Atul B. Mehta教授创建 [Citation ends].
[Figure caption and citation for the preceding image starts]: 已知会引起G6PD缺乏症患者发生溶血的药物和物质由Atul B. Mehta教授创建 [Citation ends].
在新生儿时期,由于红细胞裂解所引起的血红素流通的增加以及结合并清除胆红素能力的受损,高胆红素血症(生理性黄疸)在G6PD缺乏症患者中通常更加严重。越是严重的G6PD突变体,这种临床现象就越常见,当这个人同时又有遗传性的结合胆红素所需酶的缺陷时,高胆红素血症将会更加严重。[16][17][18][19][20]
分类
G6PD缺乏症WHO工作组[1]
酶活力的缺乏常常是缘于结构突变降低了酶的稳定性。根据生物化学和物理化学的性质,已有超过400种变异的酶被描述。这些变异体根据酶活性和临床特征被分为5组。
分类I:严重缺乏,与慢性的非球形红细胞溶血性贫血有关
分类II:严重缺乏(1%-10%残余活力),与急性溶血性贫血有关
分类III:中度缺乏(10%-60%残余活力
分类IV:正常活性(60%-150%)
分类V:增强的活性(>150%)。
使用此内容应接受我们的免责声明。
